Реакция антиген — антитело
Реакция антиген — антитело (ААР, Antigen-antibody interaction, antigen-antibody reaction) — образование комплекса между антигеном и направленными к нему антителами[1].
Общие сведения[править]
Первое описание ААР представлено Ричардом Голдбергом (Richard J. Goldberg, 1952) в Висконсинском университете[2].
Различают две фазы реакции. В 1-й фазе реакции осуществляет соединение детерминантной группы антигена или гаптена с группировками в активном центре антитела. Этот высокоспецифический процесс протекает в водных растворах с большой скоростью. Антитела обладают минимум 2-я (антитела IgG-класса) и максимум 10-ю (для IgM-антител) активными центрами, которые конфигурационно комплементарны детерминантной группе антигена. Поэтому с поливалентным антигеном (содержащим несколько детерминантных групп) может осуществляться создание сложных агрегатов антиген — антитело с молекулярной формулой: (Ат)x (Аг)y, где Ат — антитело и Аг — антиген. Агрегаты этого иммунного комплекса утрачивают растворимость в изотонических растворах и выпадают в осадок. Эта 2-я неспецифическая фаза протекает медленнее первой — специфической, её скорость зависит от многих внешних факторов и в первую очередь от солевого состава среды. Характер реакций, протекающих во второй фазе, определяется в сущственной мере физическими свойствами антигена.
Если в реакции участвуют низкодисперсные антигены (клетки, частицы инертного носителя с адсорбированным на них антигеном), наблюдается феномен агглютинации. Высоко дисперсные антигены (полисахариды, белки и их комплексы) формируют с антителами преципитаты (флоккуляты).
В ходе 2-й фазы антиген — антитело реакция происходит также присоединение к иммунному комплексу комплемента, что служит высокочувствительным серологическим тестом.
В случае бивалентных антител (например, антител класса IgG) их реакцию с моновалентным гаптеном (Г) описывается в виде уравнения:
где к1 и к2 — соответственно константы скоростей прямой и обратной реакций. Величина константы скорости прямой реакции, полученная в эксперименте, достигает 106−107 л•моль−1сек−1, в то время как обратная реакция заметно медленнее: 1−50 сек−1.
Из-за высокой скорости прямой реакции соединение антитела с гаптеном завершается ещё в процессе смешивания реагентов. Проще измерять константу сродства (ка=к1/к2), величина которой для ряда систем, рассчитанная с применением метода равновесного диализа, находится в пределах 105−109 л/моль.
На базе данных о величине ка при различных температурах по уравнению Вант-Гоффа вычисляют термодинамические параметры реакции гаптен — антитело.
Изменения свободной энергии (дельтаF) при взаимодействии гаптен — антитело имеют порядок величин от −7 до −12 ккал/моль. Поэтому, даже при высоких разведениях степень ассоциации остаётся существенной. Несмотря на то, что порой не отмечались заметные изменения энтропии при формировании комплекса гаптен — антитело (ΔS = 0), для многих систем были получены положительные значения ΔS, указывающие на увеличение энтропии, а не на её уменьшение, что следовало бы ожидать в силу большей упорядоченности системы при образовании иммунного комплекса.
Для связывания существует динамическое равновесие. Например, реакция является обратимой и может быть выражена в виде:
- [Ab] + [Ag] ⇔ [AbAg]
где [Ab] — концентрация антител, а [Ag] — концентрация антигена, либо в свободном ([Ab], [Ag]), либо в связанном ([AbAg]) состоянии.
Тем самым, константа равновесной ассоциации может быть представлена в виде:
где K — постоянная равновесия.
Взаимно постоянная диссоциации будет равна:
Эти уравнения применимы только к одному связыванию эпитопов, то есть к одному антигену на одном антителе. Поскольку антитело обязательно имеет два паратопа, и во многих обстоятельствах происходит сложное связывание, равновесие множественного связывания можно суммировать как:
где в равновесии c-концентрация свободного лиганда, r представляет собой отношение концентрации связанного лиганда к общей концентрации антител, а n-максимальное количество сайтов связывания на молекулу антитела (валентность антитела).
Взаимодействие молекулы антигена с антителом или его активным Fab-фрагментом сопровождается изменениями пространственной структуры молекулы антигена. В частности, миоглобин превращается в апомиоглобин при взаимодействии с антителами, направленными к апомиоглобину, а неактивная, полученная от соответствующих мутантов ß-галактозидаза превращается в активный фермент после реакции с антителами к активной форме ß-галактозидазы. В экспериментах с синтетическими полипептидами, использованными в качестве антигенов, было отчетливо продемонстрировано, что антитела к α-спиральной форме полипептида способны стабилизировать эту структуру и, более того, обеспечивать структурный переход пептидов из формы неупорядоченного клубка в α-спираль.
Из-за структурной гетерогенности антител найденные в эксперименте константы сродства (ка) гаптена к антигену представляют собой усредненную величину многих констант, отражающих особенности связывания гаптена разными молекулами антител. Распределение антител по константам сродства описывается кривой Гаусса. Так как в составе популяции молекул антител всегда присутствуют такие, которые отличаются относительно низкой степенью сродства, число молекул гаптена, связанных на моль бивалентного антитела, достигает величины 2 лишь при заметном избытке гаптена. Путём преципитации антител к динитрофенильной группе возрастающими количествами специфического антигена удалось получить несколько фракций антител, отличающихся у одного и того же животного по сродству к гаптену на четыре порядка (от 1,0•105 до 1,1•109). При повторных иммунизациях величина ка для более поздних антител растёт особенно заметно тогда, когда для иммунизации используются небольшое число антигена. Антиген соединяется в организме в 1-ю очередь с рецепторами предшественников антителообразующих клеток, отличающихся наибольшим сродством к антигену. При иммунизации большими дозами антигена гетерогенность антител по величине ка возрастает за счёт вовлечения в иммунный ответ клеток с антителоподобными рецепторами, характеризующимися низким сродством к антигену и обладающими способностью синтезировать лишь антитела с низкой степенью сродства.
При оценке кинетических параметров ААР зачастую прибегают к определению константы равновесия (к), которую рассчитывают в эксперименте по ингибированию ААР при помощи специфического гаптена на базе следующего уравнения:
[АгАт] = к [ГАт] [Аг]/[Г],
де каждая величина в скобках означает молекулярную концентрацию вещества. Величина (к) в общем случае близка по значению величине ка. Метод ингибирования реакции преципитации имеет широкое применение для оценки структуры детерминантных групп природных антигенов — белков и полисахаридов. В данном случае в качестве гаптенов применят олигосахариды и пептиды.
Наличием минимум двух валентностей у антигена и антитела не исчерпываются требования, необходимые для формирования иммунных преципитатов, и для реализации прочих процессов, протекающих во 2-й фазе ААР. Так, хотя антитела, относящиеся к классам IgA и IgE, содержат по 2 активных центра, они в сущности не участвуют в реакциях преципитации и агглютинации и не связывают комплемент в присутствии специфического антигена.
В присутствии низкомолекулярного бивалентного гаптена, взаимодействующего с обоими активными центрами антитела, угол между Fab-фрагментами равен 10°, но может вырасти до 180° при соотношении гаптен — антитело (или антиген — антитело), обеспечивающем формирование крупных агрегатов, в состав которых входит 4 и более молекул антител. После взаимодействия с антигеном молекула антитела превращается из Y-образной в стержнеобразную с максимально удаленными друг от друга активными центрами, находящимися на дистальных концах Fab-фрагментов.
При промывании иммунного преципитата физиологическим раствором из его состава можно выделить постоянно уменьшающиеся количества антител и лишь следовые количества антигена. Процесс диссоциации описывается следующим уравнением:
где n и m соответствуют числу молекул Аг и Ат в комплексе и числу свободных молекул Ат.
Эффективность диссоциации иммунного комплекса значительно растёт в присутствии большого избытка антигена (гаптена).
Источники[править]
- ↑ АНТИГЕН—АНТИТЕЛО РЕАКЦИЯ // БМЭ
- ↑ Goldberg, Richard J. (1952). «A Theory of Antibody—Antigen Reactions. I. Theory for Reactions of Multivalent Antigen with Bivalent and Univalent Antibody». Journal of the American Chemical Society. 74 (22): 5715-5725.
 | Одним из источников, использованных при создании данной статьи, является статья из энциклопедии «Традиция» под названием «Антиген — антитело реакция», расположенная по адресу:
Материал указанной статьи полностью или частично использован в Циклопедии по лицензии GNU FDL. |
|---|

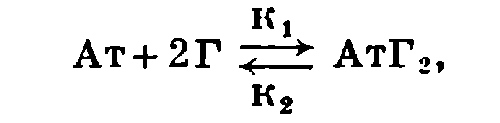
![{\displaystyle K_{a}={\frac {k_{on}}{k_{off}}}={\frac {[AbAg]}{[Ab][Ag]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/46368304ba95b605fe61897380bc52c44a2e410f)
![{\displaystyle K_{d}={\frac {k_{off}}{k_{on}}}={\frac {[Ab][Ag]}{[AbAg]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/073db051f14cbf65917748599c059da7d41c2719)
![{\displaystyle K_{a}={\frac {k_{on}}{k_{off}}}={\frac {[AbAg]}{[Ab][Ag]}}={\frac {r}{c(n-r)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d57d062c309e834ba6efd644a4018d902cbb8ad5)