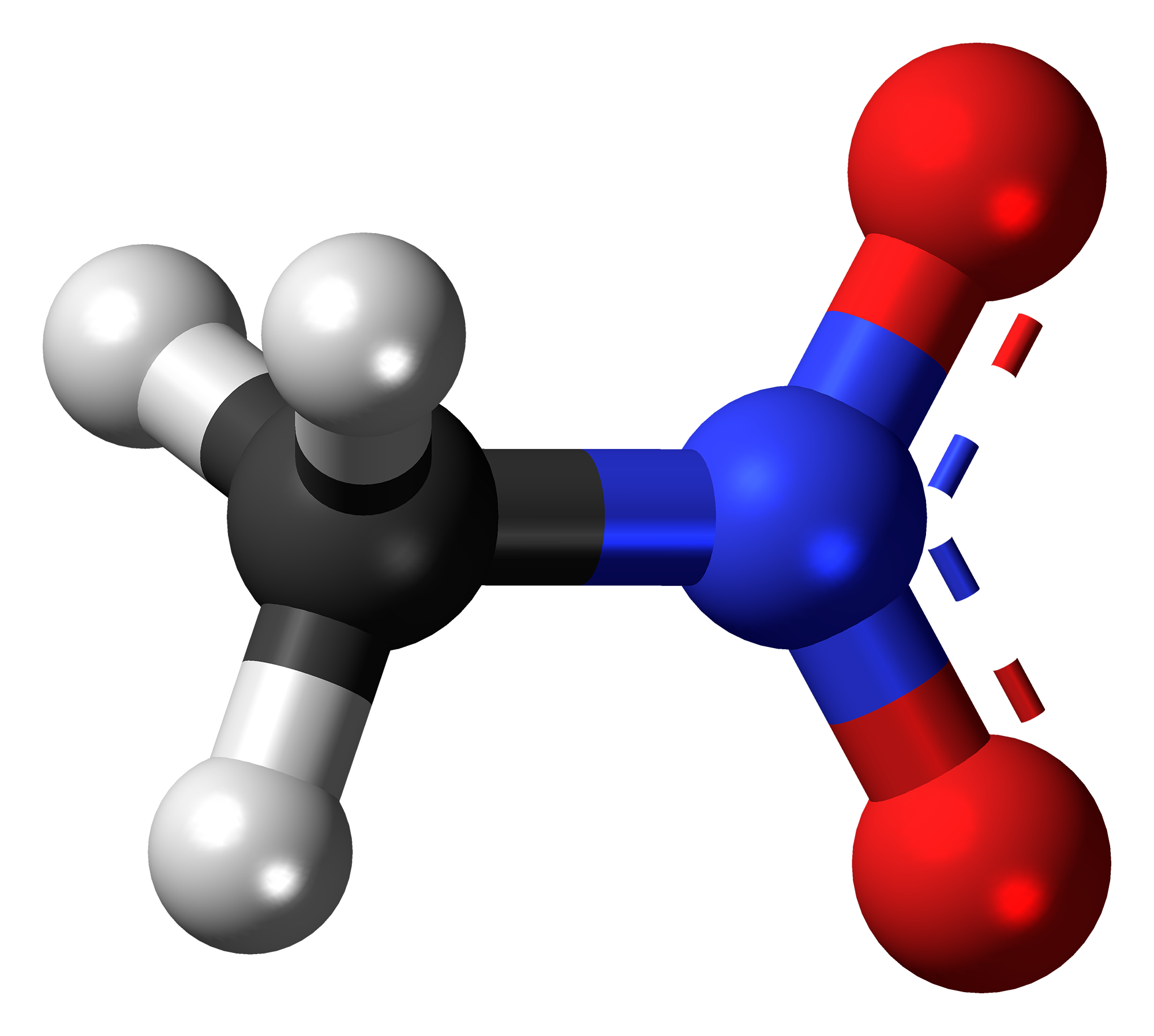
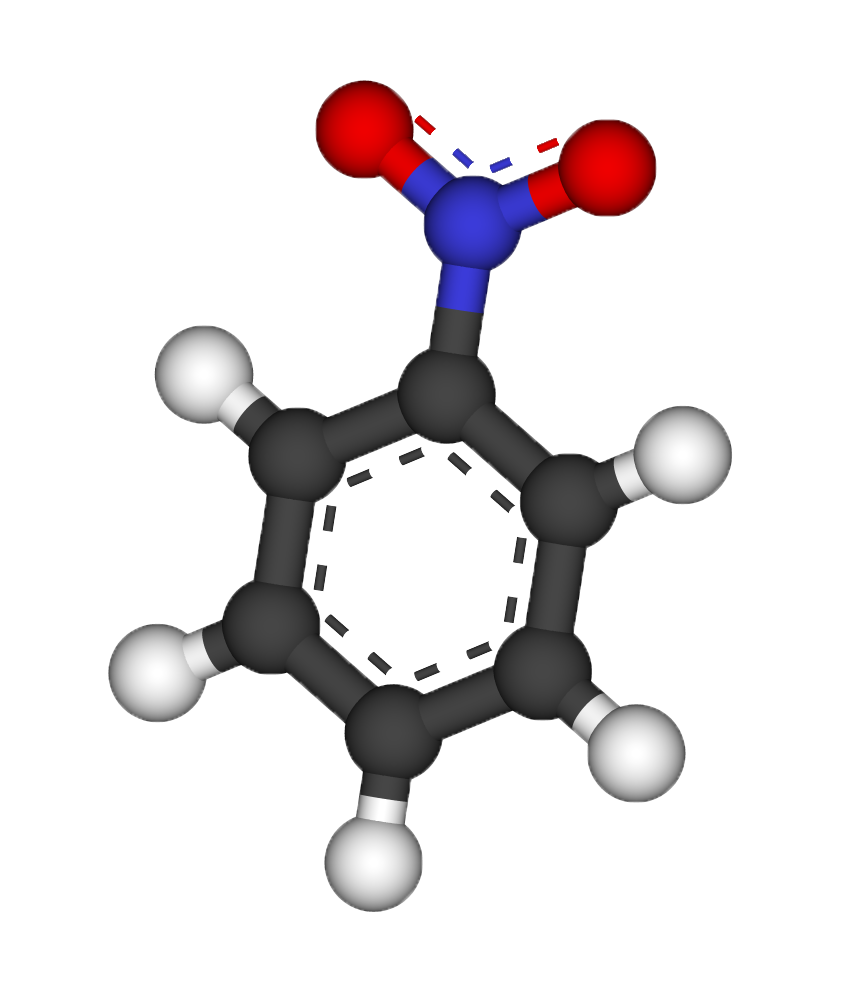
Нитросоединения
Нитросоедине́ния — органические вещества, в молекулах которых содержится нитрогруппа , которая соединена с углеводородным радикалом. Общую формулу нитросоединений можно записать в виде . O-нитросоединения и N-нитросоединения выделяют в отдельные классы[1].
Номенклатура[править]
Название нитросоединений происходит от названия углеводорода с приставкой нитро-. Положение нитрогруппы указывается с помощью цифр общепринятым способом. Нитрогруппа, образующаяся из нитрозогруппы, представляет собой интересный феномен, объясняемый взаимодействием атомов азота и кислорода. В обычной ковалентной связи атом азота отдаёт один электрон своей внешней оболочки для образования связи с атомом кислорода, который в свою очередь получает этот электрон, обогащая свою оболочку. Однако, при образовании нитрогруппы, атом азота отдаёт два электрона, что приводит к приобретению положительного элементарного заряда. Атом кислорода, в свою очередь, не только не отдаёт электроны, но и получает один электрон свободной пары азота, что приводит к приобретению отрицательного заряда. Таким образом, связь между атомом кислорода и азота в нитрогруппе является уникальной, комбинируя в себе ионообразные и ковалентные свойства. Это называется семиполярной связью. Важно отметить, что семиполярные связи встречаются не только в нитрогруппах, но и в других органических соединениях, где происходит смешение ионной и ковалентной природы связи.
Нитрогруппы имеют большое значение в органической химии и фармацевтической промышленности. Они часто используются в производстве взрывчатых веществ, пигментов, красителей и лекарственных препаратов. Например, нитроглицерин, широко известный как взрывчатое вещество, содержит нитрогруппу, которая придаёт ему его характерные свойства. Кроме того, нитрогруппы играют важную роль в сельском хозяйстве. Некоторые азотсодержащие удобрения содержат нитрогруппы, которые обеспечивают постепенное высвобождение азота в почву, способствуя росту растений. Нитрогруппы представляют собой уникальные связи, объединяющие ионообразные и ковалентные свойства. Их широкое использование в различных областях подчеркивает их важность и значимость в повседневной жизни человека[2].
Примеры нитросоединений:
(нитрометан) (1,2-динитроэтан) (2-нитробутен-2)
Строение нитрогруппы[править]
Нитрогруппа имеет плоскую геометрию. Азот и кислород находятся в состояние —гибридизации.
Связь длину 0,122 нм, угол длина связи 0,147 нм. В каждой из граничных структур присутствует семиполярная взаимосвязь — ковалентная связь между азотом и кислородом, возникающая благодаря передаче электронной пары только одним из атомов азота. Как следствие, оба атома приобретают электрический заряд: атом кислорода, являющийся акцептором электронной пары, получает отрицательный заряд, в то время как атом азота, являющийся донором электронной пары, приобретает положительный заряд[2].
Физические свойства[править]
Нитропроизводные низших алканов представляют собой бесцветную жидкость со специфическим запахом, а нитроалканы высших — твёрдые кристаллические вещества. Нитросоединения имеют высокую температуру кипения. Обладают высокой плотностью. В воде мало растворимы, смешиваются со спиртом, эфиром, ядовиты[2].
Химические свойства[править]
Важное химическое свойство нитросоединений — быть окислителями.
1) При гидрировании нитросоединений образуются амины.
2) При действии концентрированных сильных кислот нитросоединения гидролизуются.
3) Алюминий и цинк в щелочной среде образуют гидроксокомплексы.
Реакции замещения нитробензола: при хлорировании нитробензола образуется мета-хлорнитробензол[3].
Получение[править]
Нитросоединения широко используются в промышленности как растворители, взрывчатые и лекарственные вещества и т. д. Органические вещества, содержащие нитрогруппу, довольно редко встречаются среди природных соединений. В большинстве своём их получают методами органического синтеза.
Основным способом получения нитросоединений является нитрование углеводородов. Нитрование проводят в разбавленной азотной кислоте при температуре 140—150 градусов.
1) Реакция Коновалова:
2) Реакции алкилгалогенидов с нитритами металлов:
где Hal = I,Br
3) Взаимодействии галогенпроизводных углеводородов с нитритом серебра
Представители[править]
[3].
Литература[править]
- Хомченко, Иван Гавриилович. Общая химия : Учебник для техникумов / И. Г. Хомченко. — Москва : Химия, 1987. — С. 464.
- Кнунянц И. Л. и др. Т. 3. : Мед-Пол // Химическая энциклопедия. — Москва : Большая Российская энциклопедия, 1992. — 639 с. — ISBN 5-82270-039-8
Примечания[править]
- ↑ Тронов Б. В., Кулев Л. П. Комплексы нитросоединений бензольного ряда с кислотами // Известия ТПУ. — 1936. — № 1-3. — С. 10.
- ↑ 2,0 2,1 2,2 Нитросоединения. Национальный исследовательский Томский политехнический университет. Проверено 16 декабря 2023.
- ↑ 3,0 3,1 3,2 Нитросоединения. CHEMEGE.RU. Проверено 16 декабря 2023.
 | Одним из источников, использованных при создании данной статьи, является статья из википроекта «Знание.Вики» («znanierussia.ru») под названием «Нитросоединения», расположенная по следующим адресам:
Материал указанной статьи полностью или частично использован в Циклопедии по лицензии CC-BY-SA 4.0 и более поздних версий. Всем участникам Знание.Вики предлагается прочитать материал «Почему Циклопедия?». |
|---|












![{\displaystyle {\ce {R-NO2 +2Al + KOH + 4H2O -> R-NH2 +2K[Al(OH)4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fe8ca9ca385f59652e0a6e421ed28f9cfd55f58b)
![{\displaystyle {\ce {CH3-H + HO-NO2 A ->[140-150] CH3-NO2 + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/255d89efede0d580de84d19dc450f16bb6f22596)