Кислород
Кислород
- Символ, номер
- O, 8
- Атомная масса
- 15,99903 а.е.м.
- Электронная конфигурация
- [He] 2s2 2p4
- Электроотрицательность
- 3,44 по шкале Полинга
- Степени окисления
- −2; −1; −0,5; −1/3; 0; +0,5; +1; +2
- Плотность
- 0,00142897 г/см3
- Температура плавления
- 54,8 K
- Температура кипения
- 90,19 K
- Молярная теплоёмкость
- Дж/(K·моль)
- Структура кристаллической решетки
- моноклинная
- Теплопроводность
- (300 K) 0,027 Вт/(м·К)
Кислород (лат. Oxygenium) — химический элемент c атомным номером 8.
Обозначается символом O.
Описание[править]
Кислород — буквально «тот, что порождает кислоту». Русское слово восходит к М. В. Ломоносову и является калькой французского слова oxygène, предложенного А. Лавуазье (от др.-греч. ὀξύς — «кислый» и γεννάω — «рождаю»).
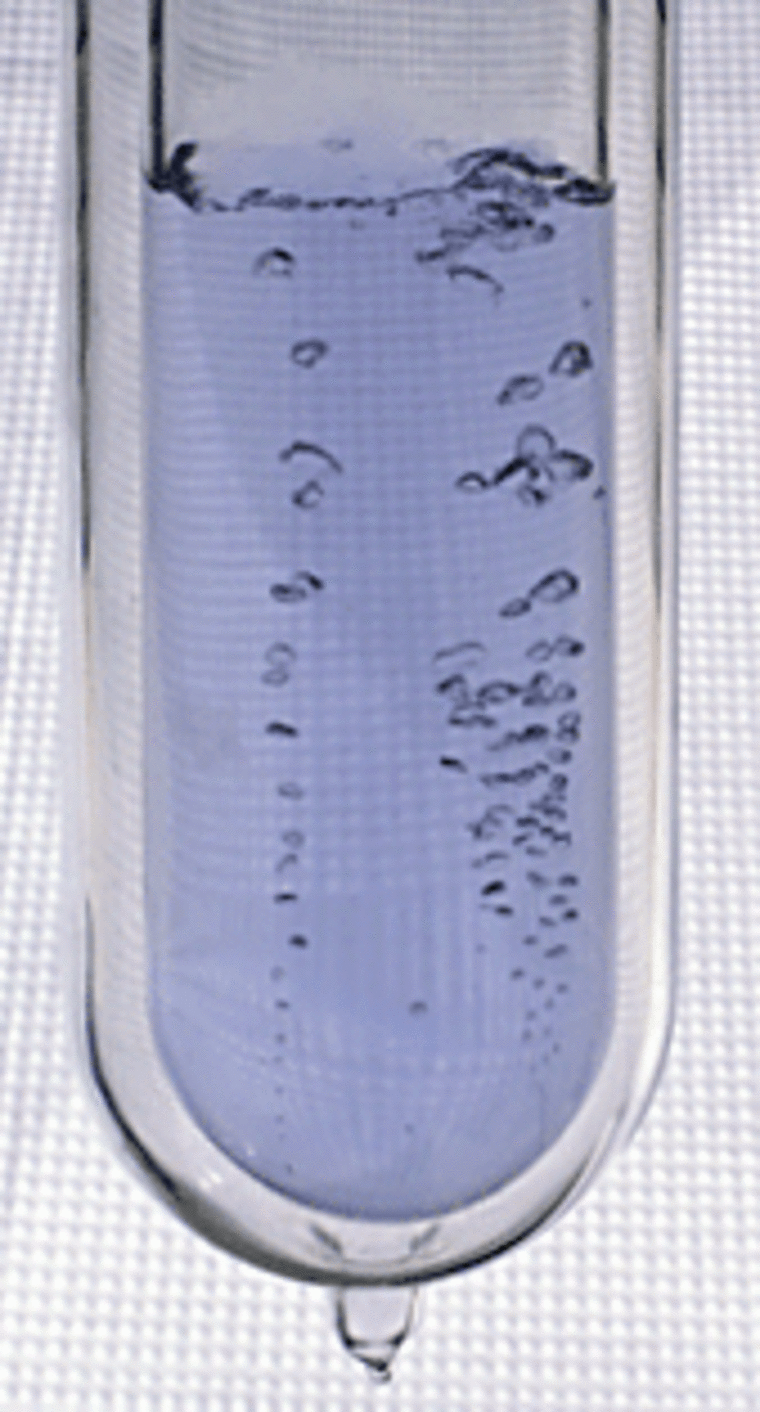
Атомный номер кислорода — 8; атомная масса — 15,9994. Кислород образует соединения со всеми элементами, кроме гелия, аргона и неона. При нормальных условиях кислород — газ, состоящий из двухатомных молекул. При 90,18 К кислород конденсируется в бледно-голубую жидкость, при 54,36 К — затвердевает. Есть и другие аллотропные формы кислорода, в частности трехатомный кислород (формула O3) называется озон — при нормальных условиях газ голубого цвета со специфическим запахом.
Плотность жидкого кислорода — 1,144; температура плавления составляет −218 ° C, температура кипения составляет −183 ° C.
С некоторыми металлами кислород образует пероксиды, надпероксиды, озониды, а с горючими газами — взрывчатые смеси.
Элемент кислород занимает третье место после водорода и гелия по распространенности в Вселенной. Он — самый распространенный химический элемент на Земле — 47 % массы земной коры, 85,7 % массы гидросферы, 23,15 % массы атмосферы, 79 % и 65 % массы растений и животных соответственно. За объемом кислород занимает 92 % объема земной коры. Известно около 1400 минералов, содержащих кислород, главные из них — кварц, полевые шпаты, слюда, глинистые минералы, карбонаты. Более 99,9 % кислорода Земли находится в связанном состоянии. Кислород — фактор, который регулирует распределение элементов в планетарном масштабе. Содержание его с глубиной закономерно уменьшается. Количество кислорода в магматических породах меняется от 49 % в гранитах до 38−42 % в дунитах и кимберлитах. Содержание кислорода в метаморфических породах соответствует глубине их формирования: от 44 % в эклогитах 48 % в кристаллических сланцах. Максимум кислорода — в осадочных породах — 49−51 %. Исключительную роль в геохимических процессах играет свободный кислород — молекулярный кислород, значение которого определяется его высокой химической активностью, большой миграционной способностью и постоянным, относительно высоким содержанием в биосфере, где он не только расходуется, но и воспроизводится. Считается, что свободный кислород появился в протерозое в результате фотосинтеза.
В гипергенных процессах кислород — один из основных агентов, он окисляет сероводород и низшие оксиды. Кислород определяет поведение многих элементов: повышает миграционную способность халькофилов, окисляя сульфиды до подвижных сульфатов, снижает подвижность железа и марганца, осаждая их в виде гидроксидов и вызывая тем самым их разделение. В водах океана содержание кислорода меняется: летом океан отдает кислород в атмосферу, зимой поглощает его. Полярные регионы обогащены кислородом. Важное геохимическое значение имеют соединения кислорода, в частности вода.
Основной промышленный метод получения кислорода — разделение воздуха методом глубокого охлаждения. Как побочный продукт кислород получают при электролизе воды. Разработан способ получения кислорода методом выборочной диффузии газов через молекулярные сита. Газообразный кислород применяется в металлургии для интенсификации доменных и сталеплавильных процессов, при выплавке цветных металлов в шахтных печах, бессемеровании штейнов и др. (Более 60 % потребляемого кислорода); как окислитель во многих химических производствах; в технике — при сварке и резке металлов; при подземной газификации угля и т. п.; озон — при стерилизации питьевой воды и дезинфекции помещений. Жидкий кислород используют как окислитель для некоторых разновидностей ракетного топлива.
История[править]
Кислород был открыт в 1773 году шведским химиком К. В. Шееле, и независимо от него в 1774 году — английским ученым Джозефом Пристли. Французский химик Антуан Лавуазье дал новому элементу его название, а в 1777 году создал кислородную теорию дыхания, горения и окисления. В свободном виде известен, как молекулярный кислород (O2) и озон (O3).
Еще в VIII веке установлено наличие в воздухе газа, поддерживающего дыхание и горение. Однако европейцы кислород открыли почти через 1000 лет. Шведский химик К. В. Шееле в 1771 году установил, что воздух состоит из кислорода и азота.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, опубликовавшего свои работы по окислению ртути и последующего разложения ее оксида.
В 1774 году Дж. Пристли добыл кислород разложением оксида ртути HgO. Но все же главные лица в истории открытия кислорода — это не К. В. Шееле и не Дж. Пристли. Они открыли новый газ — кислород, но несмотря на это до конца жизни оставались ревностными защитниками теории флогистона, которая длительное время тормозила развитие науки. Особое значение в истории открытия кислорода имеют работы А. Лавуазье. Он в 1775 году установил, что кислород — составная часть воздуха, создал кислородную теорию горения (за 200 лет она не только не была опровергнута, но и получила множество подтверждений своей истинности), которая пришла на смену теории флогистона. В 1898 году английский ученый Томпсон, лорд Кельвин, утверждал, что человечеству грозит удушье, поскольку в воздух выделяется огромное количество углекислого газа не только от дыхания, но и от промышленных предприятий. Это утверждение опроверг К. А. Тимирязев. Он доказал, что человечеству не дадут погибнуть зеленые растения, выделяющие кислород в ходе фотосинтеза.
Распространение в природе[править]
Кислород — самый распространенный на Земле элемент, содержание его составляет 47 % по массе (в основном в форме оксидов), в воздухе (тропосфере) кислорода (O2) — 20,93 % по объему, или 23 % по массе. В состав воды входит 88,8 % кислорода, в морской воде — 85,7 %. Он входит в состав большинства горных пород, почв, а также клеток всех растительных и животных организмов. Кислород в целом составляет 30-85 % массы животных и растительных тканей. Он входит в состав белков, нуклеиновых кислот, жиров, углеводов и т. п. Свободный кислород играет большую роль в биохимических и физиологических процессах, в частности в дыхании. При недостаточном снабжении организма животных и человека кислородом развивается гипоксия. Зеленые растения и некоторые бактерии являются источником свободного кислорода на Земле.
Во Вселенной кислород — третий по распространенности химический элемент после водорода и гелия.
Физические свойства[править]
Кислород — бесцветный газ без запаха и вкуса. При температуре −183 ° С он конденсируется в жидкость голубоватого цвета, при −218,7 ° С замерзает в синюю кристаллическую массу. Растворимость кислорода в воде невелика и при обычной температуре составляет всего 3,1 см3 в 100 г воды. В продажу кислород поступает в стальных баллонах под давлением примерно 150 атм.
Твердый кислород (температура плавления −218,79 ° C) существует в виде синих кристаллов. Известны шесть кристаллических фаз, из которых три существуют при давлении в 1 атм:
- α-О2 — существует при температуре ниже 23,65 K; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a = 5,403 Å, b = 3,429 Å, c = 5,086 Å; β = 132,53 °.[1]
- β-О2 — существует в интервале температур от 23,65 до 43,65 К; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решетку, параметры ячейки a = 4,21 Å, α = 46,25 °[1]
- γ-О2 — существует при температурах от 43,65 до 54,21 К; бледно-синие кристаллы имеют кубическую симметрию, с периодом решетки a = 6,83 Å.[1]
Химические свойства[править]
Кислород относится к главной подгруппе VI группы периодической системы элементов. Его порядковый номер 8.
Молекула кислорода состоит из двух атомов. Химическая связь ковалентная. Упрощенная структурная формула: O = O.
Существует также высокоэнергетическая синглетная форма молекулы кислорода. Она очень химически активна, и быстро реагирует с органическими соединениями. Синглетный кислород образуется в процессе фотосинтеза, и иммунной системой. Он также возникает в тропосфере вследствие фотолиза озона.
Имея во внешней электронной оболочке шесть электронов, атомы кислорода энергично присоединяют от атомов других элементов два электрона, которых им не хватает для завершения валентной оболочки, и превращаются в негативные двухвалентные ионы:
- O + 2e = O2-
При этом кислород проявляет свои окислительные свойства. Из всех химических элементов он является одним из сильнейших окислителей и уступает в этом только фтору. Кислород непосредственно соединяется со всеми элементами, за исключением инертных газов, галогенов и благородных металлов. Химическая активность кислорода возрастает с повышением температуры.
- 4Na + O2 = 2Na2O
Кислород хорошо растворим в органических растворителях, поглощается тонкими порошками металлов, угля. Образует соединения со всеми элементами, кроме гелия, аргона и неона. На основе типов и свойств кислородных соединений построена классификация неорганических соединений. С металлами и неметаллами кислород образует оксиды соединений, с щелочными металлами, кроме лития, — пероксиды. Взаимодействие веществ с кислородом значительно ускоряется при нагревательной действия электрических разрядов, под давлением, при наличии катализаторов, особенно воды. В смеси с горючими газами и паром, с тонкими порошками многих металлов и органических веществ газообразный кислород образует взрывчатые смеси. Он легко окисляет органические соединения.
- CH3CH2OH + 3O2 = 2CO2 + 3H2O
Получение[править]
В лабораториях кислород обычно получают термическим разложением некоторых пероксидов, солей некоторых кислородосодержащих кислот (например, перманганата калия KMnO4, бертолетовой соли KClO3):
- 2KClO3 = 2KCl + 3O2↑
При 368 ° C эта соль плавится, а около 400 ° C начинает разлагаться. В присутствии диоксида марганца MnO2 (катализатор) температура разложения снижается и реакция проходит легче.
В промышленности кислород добывают фракционированной перегонкой жидкого воздуха и электролизом воды. С этой целью воздух сначала сжижают сильным охлаждением под большим давлением, а затем медленно испаряют из него азот. Очень чистый кислород добывают электролизом водного раствора гидроксида натрия NaOH с применением никелевых электродов. При этом на катоде восстанавливаются катионы водорода, а на аноде окисляются гидроксильные анионы с выделением кислорода.
В целом электролиз водного раствора NaOH сводится к электролизу воды, однако раствор NaOH имеет лучшую, чем вода, электролитическую проводимость, что и обуславливает его использование.
Электролитическим способом кислород получают и для промышленных нужд, в частности там, где есть дешевая электрическая энергия.
Применение[править]
Кислород воздуха имеет чрезвычайно важное значение для процессов горения. Сжигая различные виды топлива, получают тепло, которое используют для удовлетворения самых различных потребностей, в том числе для преобразования его в механическую и электрическую энергию. При участии кислорода воздуха сгорает топливо на теплоэлектростанциях, топливо в двигателях автомобилей, выжигают металлические руды на заводах цветной металлургии.
Сварка и резка металлов[править]
Чистый кислород с ацетиленом широко используют для так называемой автогенной сварки стальных труб и других металлических конструкций и их резки. Для этого служит специальная горелка, который состоит из двух металлических трубок, вставленных друг в друга. В пространство между трубками пропускают ацетилен и зажигают, а затем по внутренней трубке пропускают кислород. Оба газа, подаются из баллонов под давлением. Температура в кислородно-ацетиленовом пламени — до 2000 ° C, при такой температуре плавится большинство металлов.
В медицине[править]
Кислород — биогенный химический элемент, обеспечивающий дыхание большинства живых организмов на Земле. Физиологическое действие кислорода разностороннее, решающее значение в его лечебном эффекте имеет способность возмещать дефицит кислорода в тканях организма при гипоксии (недостаточного снабжения тканей кислородом или нарушения его усвоения).
Ингаляцией (вдыханием) кислорода широко пользуются при различных заболеваниях, сопровождающихся гипоксией (нехваткой кислорода): при заболеваниях органов дыхания (пневмония, отек легких и т. д.), сердечно-сосудистой системы (сердечная недостаточность, коронарная недостаточность, резкое падение артериального давления и т. п.), отравлениях угарным газом, синильной кислотой, удушающими веществами (хлор, фосген и др.), а также при других заболеваниях с нарушением функции дыхания и окислительных процессов.
В анестезиологической практике кислород широко применяется в смеси с ингаляционными наркотическими анальгетиками. Чистым кислородом и смесью его с углекислотой пользуются при ослаблении дыхания в послеоперационном периоде, при интоксикациях и т. д.
Широко пользуются кислородом для так называемой гипербарической оксигенации — применения кислорода под повышенным давлением. Установлена высокая эффективность этого метода в хирургии, интенсивной терапии тяжелых заболеваний, особенно в кардиологии, реаниматологии, неврологии и других областях медицины.
Применяют также энтеральную оксигенотерапию (введение кислорода в кишечник или желудок) путем введения в желудок кислородной пены, применяемой в виде так называемого кислородного коктейля. Используется для общего улучшения обменных процессов в комплексной терапии сердечно-сосудистых заболеваний, нарушений обмена веществ и других патологических состояний, связанных с кислородной недостаточностью организма.
Чистым кислородом пользуются для дыхания также летчики при высоких полетах, водолазы, на подводных лодках и т. п.
Кислородные подушки применяют при некоторых заболеваниях для облегчения дыхания.
В металлургии[править]
Кислород широко применяется для интенсификации химических и металлургических процессов. Чистый кислород используют, в частности при производстве серной и азотной кислот, синтетического метилового спирта CH3OH и других химических продуктов.
При вдувании в доменную печь обогащенного кислородом воздуха значительно повышается температура печи, ускоряется процесс выплавки чугуна, увеличивается производительность доменов и экономится кокс. В 1871 году Генри Бессемер взял патент на вдувания в печь воздушного дутья, обогащенного кислородом.
Обогащение дутья кислородом позволяет интенсифицировать доменный процесс. В воздухе содержится примерно 21 % кислорода. Полученное из атмосферы дутья также содержать 21 % кислорода. Однако, дутьё можно обогатить, добавив к нему кислород перед вдуванием в печь. Чем больше кислорода содержит дутьё, тем больше топлива можно сжечь в единицу времени, то есть вести доменный процесс более ускоренно. 1 % дополнительного кислорода в дутье дает увеличение производства примерно на 3 %.
Идея о целесообразности обогащения дутья кислородом была высказана еще в XIX веке. Однако, широкое использование обогащенного кислородом воздуха в доменном производстве и в металлургии вообще задержалось на долгое время. Это было обусловлено высокой стоимостью кислорода, а также нарушениями в технологическом процессе, возникавшие при выплавке перерабатывающих чугунов.
После многих промышленных исследований была отработана теория и технология доменной плавки с использованием обогащенного кислородом дутья.
В сельском хозяйстве[править]
В тепличном хозяйстве, для увеличения массы животных, для обогащения кислородом водной среды в рыбоводстве.
Ракетное топливо[править]
Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород-озон превышает удельный импульс для пары водород — фтор и водород — фторид кислорода).
Взрывчатые вещества[править]
Для изготовления взрывчатых смесей — так называемых оксиликвиты используют жидкий кислород. Это смеси древесных опилок, сухого торфа, порошка угля и других горючих веществ, спрессованных в специальных патронах и пропитанных перед употреблением жидким кислородом. При воспалении такой смеси электрической искрой она взрывается с большой силой. Оксиликвиты применяют при разработке рудных залежей взрывным способом, при прокладке тоннелей в горах, рытье каналов и др.
Биологическая роль кислорода[править]
Большинство живых существ (аэробы) дышат кислородом воздуха. Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену (кислородный коктейль). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьезных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, легочной вентиляции.
Токсичные производные кислорода[править]
Некоторые производные кислорода (реактивные формы кислорода), такие как синглетный кислород, перекись водорода, супероксид, озон и гидроксильный заместитель, являются высокотоксичными продуктами. Они образуются в процессе активирования или частичного восстановления кислорода. Супероксид (супероксидный заместитель), перекись водорода и гидроксильный заместитель могут образовываться в клетках и тканях организма человека и животных и вызывают оксидативный стресс.
Изотопы[править]
Кислород имеет три устойчивых изотопа: 16O, 17O и 18O, среднее содержание которых составляет соответственно 99,759 %, 0,037 % и 0,204 % от общего числа атомов кислорода на Земле. Резкое преобладание в смеси изотопов легкого из них 16О связано с тем, что ядро атома 16О состоит из 8 протонов и 8 нейтронов (дважды магическое ядро с заполненными нейтронной и протонной оболочками). А такие ядра, как следует из теории строения атомного ядра, особенно устойчивы.
Также известны радиоактивные изотопы кислорода, которые имеют малый период полураспада.
Факты о кислороде[править]
- Кислород воздуха, от которого зависит жизнь человека, впервые появился в атмосфере Земли благодаря деятельности фотосинтезирующих бактерий.
- Большинство живых организмов зависит от кислорода. Обладая высокой химической активностью, он способен окислять («забирать» электроны) у многих химических веществ. Эти реакции происходят с выделением энергии необходимой для поддержания всех жизненных процессов организма. Процесс окисления органических веществ кислородом происходит в митохондриях живых клеток и называется клеточным дыханием.
- Лавуазье открыл, что вода — соединение водорода и кислорода. До этого вода считалась простым веществом.
- Озон, (молекулы которого содержат 3 атома кислорода) составляет 0,00006 % воздуха. Он образуется при диссоциации (распаде) двухатомных молекул кислорода под действием ультрафиолетовых лучей солнечного спектра.
- Ученые NASA нашли в экзосфере (верхнем слое атмосферы) спутника Сатурна Дионы кислород. Данное открытие, по словам исследователей, подтверждает теорию о том, что в атмосфере большинства спутников газовых гигантов Юпитера и Сатурна содержится кислород. Одновременно профессор Лондонского университета Эндрю Коатс заявил, что на Дионе не обнаружено признаков наличия воды, а следовательно, она непригодна для жизни. Однако, отметил ученый, на других спутниках удалось обнаружить наличие льда и воды, а это значит, что там могут быть обнаружены формы жизни.[2]
Источники[править]
Литература[править]
- Глоссарий терминов по химии // Й.Опейда, О.Швайка. Ин-т физико-органической химии и углехимии им. Л. М. Литвиненко НАН Украины, Донецкий национальный университет — Донецк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- Ф. А. Деркач «Химия» Л. 1968
- Малая горная энциклопедия . В 3-х т. / Под ред. В. С. Белецкого . — Донецк: Донбасс, 2004. — ISBN 966-7804-14-3 .
- Михаличко Б. М. Курс общей химии. Теоретические основы: Учебное пособие. — М .: Знание, 2009. — 548 с. ISBN 978-966-346-712-2
- Кириченко В. И. Общая химия: Учебное пособие. — К .: Высшая школа, 2005. — 639 с . — (ил.) ISBN 966-642-182-8
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||||
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||