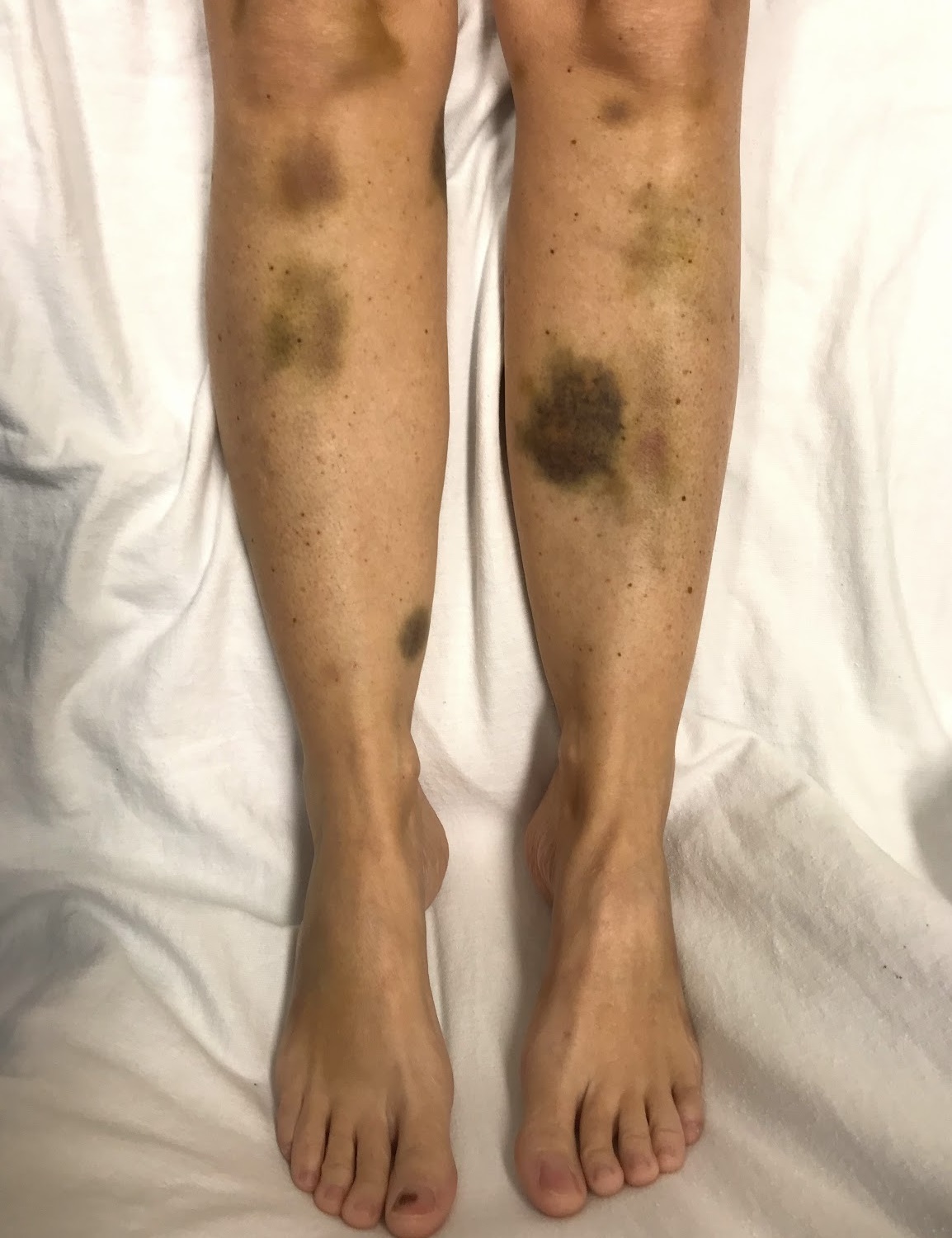
Тромботическая тромбоцитопеническая пурпура
Тромботическая тромбоцитопеническая - редкое опасное для жизни состояние, проявляющееся гемолитической анемией микроангиопатического типа, снижением уровня тромбоцитов вследствие их повышенного потребления и нарушением функции внутренних органов. Патологический механизм заболевания связан с недостаточностью металлопротеиназы ADAMTS13, ответственной за расщепление фактора Виллебранда [1].
История[править]
В 1924 году доктор Эли Московиц описал случай ранее здоровой 16 летней девушки, у которой остро развились лихорадка, слабость, очаговая неврологическая симптоматика и выраженная тромбоцитопения. В течение недели пациентка впала в кому и умерла. На аутопсии были обнаружены распространенные тромбы в терминальных артериолах и капиллярах различных органов, однако причина этого заболевания оставалась неизвестной. В 1947 году Зингер предложил термин «тромботическая тромбоцитопеническая пурпура» для обозначения этого малоизученного состояния. В 1967 году Аморози и Ультманн сформулировали классическую диагностическую пентаду тромботической тромбоцитопенической пурпуры (ТТП), включающую лихорадку, тромбоцитопению, гемолитическую анемию, поражение почек и неврологические нарушения. Их анализ клинических случаев и обзор литературы также показали, что смертность при этом заболевании превышала 90% [2][3].
Этиология[править]
ТТП по своей этиологии подразделяется на две категории в зависимости от механизма дефицита ADAMTS13:
- Врожденная (наследственная) форма (также известная как синдром Апшоу - Шульмана): обусловлена стойким тяжелым дефицитом ADAMTS13, который вызвана двуаллельными патогенными мутациями в гене, кодирующем ADAMTS13.
- Иммуноопосредованная (приобретенная) форма:
- Развивается вследствие дефицита ADAMTS13, вызванного аутоантителами.
- Подразделяется на:
Эпидемиология[править]
Иммунная ТТП обычно развивается у взрослых, составляя 90% всех случаев. Годовая заболеваемость среди взрослых составляет 1,5–6 случаев на миллион человек. В США этот показатель достигает 2,99 случаев на миллион в год, что может объясняться более высокой долей афроамериканцев, у которых риск развития ТТП примерно в восемь раз выше. В регистре Великобритании заболеваемость оценивается в шесть случаев на миллион, однако эти данные могут быть завышены, поскольку диагноз ТТП устанавливался клинически без обязательного измерения уровня ADAMTS13 во всех случаях [3].
Иммунная ТТП с дебютом в детском возрасте встречается значительно реже, составляя около 10% всех случаев. Данных о заболеваемости и распространенности этого состояния у детей и подростков недостаточно. Согласно Французскому национальному регистру заболеваемость иммунной ТТП у детей составляет 0,2 новых случая на миллион. В США заболеваемость среди детей оценивается в 0,1 случая на миллион. Женщины болеют иммунной ТТП в 2–3 раза чаще, что подтверждается данными регистров по всему миру [3].
Наследственный дефицит ADAMTS13, вызванный мутациями в гене ADAMTS13, встречается примерно у 3–5% пациентов с ТТП. Точная распространенность наследственной ТТП неизвестна, но, по оценкам экспертов, составляет 0,5–2 случая на миллион. Наследственная ТТП чаще всего манифестирует в детском возрасте до 10 лет, однако, согласно данным крупных регистров, в 10% случаев заболевание развивается после 40 лет [3].
В Российской Федерации данные о заболеваемости ТТП отсутствуют [1].
Патогенез[править]
Металлопротеиназа ADAMTS13 синтезируется преимущественно в печени звездчатыми клетками, хотя его продукция также обнаружена в почечных подоцитах, эндотелиальных клетках и тромбоцитах. После созревания в эндоплазматическом ретикулуме активный фермент попадает в кровоток. Единственный известный субстрат ADAMTS13 — это фактор Виллебранда. Фактор Виллебранда хранится в виде ультракрупных мультимеров в тельцах Вейбеля - Паладе и α-гранулах тромбоцитов. При активации он высвобождается, образуя гиперадгезивные нитевидные структуры на поверхности эндотелия или в плазме. Под действием кровотока эти мультимеры разворачиваются, обнажая сайты связывания тромбоцитов и участок расщепления для ADAMTS13. Это обеспечивает эффективное расщепление крупных мультимеров на более мелкие, менее активные мультимеры [5].
При дефиците ADAMTS13 (менее 10% активности) крупные мультимеры не расщепляются и накапливаются в кровотоке. Это приводит к спонтанному связыванию тромбоцитов, формированию микротромбов и окклюзии микрососудов [5].
Иммунная форма ТТП
При иммунной ТТП ключевую роль играют аутоантитела, которые либо напрямую ингибируют фермент, либо ускоряют его клиренс. Аутоантитела при иммунной ТПП преимущественно относятся к подклассу IgG4, реже — IgG1, IgA или IgM. Точные механизмы запуска аутоиммунного ответа остаются неизвестными [5].
Наследственная форма ТПП
При наследственной форме ТТП дефицит ADAMTS13 обусловлен мутациями гена. Клинические проявления возникают только после провоцирующего события (инфекция, беременность и др.) [5].
Клиническая картина[править]
Классически описывается пентада симптомов, включающая тромбоцитопению, микроангиопатическую гемолитическую анемию, лихорадку, неврологические симптомы и почечную дисфункцию. Однако в настоящее время эта пентада встречается редко, так как плазмаферез начинают до её развития. Клинические проявления, которые позволяют заподозрить тромбоцитопению, включают эпистаксис, меноррагию, гематурию и кровоточивость десен [6].
Неврологические симптомы включают очаговые проявления: головную боль, парезы, афазию, когнитивные нарушения и транзиторные ишемические атаки. Почечная дисфункция не столь выражена и редко требует диализа, хотя могут наблюдаться протеинурия, олигурия и другие симптомы. Важно учитывать сердечные осложнения, которые часто недооцениваются: острый инфаркт миокарда, застойную сердечную недостаточность, аритмии, кардиогенный шок и внезапную смерть. Естественное течение болезни без лечения приводит к смерти 90% пациентов в течение нескольких дней [6].
Диагностика[править]
Лабораторные исследования играют ключевую роль в диагностике ТТП, поскольку клинические проявления вариабельны, а поражение органов мишеней может развиваться с задержкой. Для ТТП характерны:
- анемия;
- тромбоцитопения;
- повышение концентрации непрямого билирубина;
- ретикулоцитоз;
- увеличением концентрации лактатдегидрогеназы.
Шкала PLASMIC
Шкала PLASMIC используется для оценки вероятности снижения активности ADAMTS13 ≤10% и помогает установить предположительный диагноз ТТП при соответствующей клинической картине. Обязательное условие для применения шкалы — наличие шизоцитов в периферической крови. По 1 баллу присваивается за каждый из следующих критериев:
- количество тромбоцитов <30 000 / мкл;
- признаки гемолиза (ретикулоциты >2,5%, неопределяемый гаптоглобин или непрямой билирубин >2 мг/дл);
- средний объем эритроцитов <90;
- МНО <1,5;
- креатинин <2,0 мг/дл;
- отсутствие онкологического заболевания;
- отсутствие трансплантации солидного органа или стволовых клеток.
Чем выше балл, тем больше вероятность ТТП:
- ≥6 баллов — высокая вероятность ТТП;
- ≤5 баллов — низкая вероятность ТТП.
Анализ активности ADAMTS13: активность <10% подтверждает диагноз ТТП при наличии гемолиза и тромбоцитопении.
Оценка поражения органов мишеней
- измерение концентрации тропонина (для выявления кардиальных осложнений);
- магнитно-резонансная томография головного мозга (при неврологической симптоматике) [4].
Дифференциальная диагностика[править]
Дифференциальная диагностика проводится со следующими состояниями:
- Гемолитико-уремический синдром.
- Тромботическая микроангиопатия.
- Синдром диссеминированного внутрисосудистого свертывания.
- Идиопатическая тромбоцитопеническая пурпура [4][5].
Лечение[править]
Основным методом лечения ТТП является плазмаферез в сочетании с высокими дозами кортикостероидов. Кортикостероиды уменьшают активность ретикулоэндотелиальной системы и снижают выработку аутоантител. Плазмаферез эффективно удаляет из кровотока ультракрупные мультимеры фактора Виллебранда и аутоантитела к ADAMTS13. После достижения ремиссии плазмаферез можно прекратить [4].
Цитостатические препараты (циклоспорин, циклофосфамид, винкристин) и моноклональные антитела (ритуксимаб) обычно применяются в качестве дополнительной терапии при неэффективности лечения первой линии. Добавление глюкокортикоидов и ритуксимаба к плазмаферезу позволяет сократить продолжительность терапии [4].
Спленэктомия устраняет основной источник продукции антител, однако ее эффективность варьируется[4].
Рекомендации по лечению ТТП Международного общества по тромбозу и гемостазу:
- первичное лечение ТТП: комбинация кортикостероидов и плазмафереза;
- первый острый эпизод: добавление ритуксимаба к кортикостероидам и плазмаферезу;
- рецидивирующая ТТП: рекомендуется плазмаферез, кортикостероиды, ритуксимаб и каплацизумаб;
- ремиссия с низкой активностью ADAMTS13: профилактическое применение ритуксимаба;
- беременные с дефицитом ADAMTS13 без симптомов: профилактические инфузии плазмы [7].
Прогноз[править]
ТТП без лечения приводит к летальному исходу в 90% случаев, однако своевременно начатая терапия позволяет снизить смертность до 15%. Промедление с началом лечения значительно ухудшает прогноз и увеличивает риск развития опасных для жизни осложнений. Основными причинами смерти при ТТП являются тромбоз коронарных артерий с последующим развитием острого инфаркта миокарда, застойная сердечная недостаточность и внезапная сердечная смерть [4].
Примечания[править]
- ↑ 1,0 1,1 Галстян Геннадий Мартинович, Клебанова Елизавета Евгеньевна Диагностика тромботической тромбоцитопенической пурпуры // Терапевтический архив. — 2020. — № 12.
- ↑ 2,0 2,1 M. Saha, J.K. McDaniel, X.L. Zheng Thrombotic thrombocytopenic purpura: pathogenesis, diagnosis and potential novel therapeutics // Journal of Thrombosis and Haemostasis. — 2017-10. — В. 10. — том 15. — С. 1889–1900. — ISSN 1538-7836. — DOI:10.1111/jth.13764
- ↑ 3,0 3,1 3,2 3,3 Senthil Sukumar, Bernhard Lämmle, Spero R. Cataland Thrombotic Thrombocytopenic Purpura: Pathophysiology, Diagnosis, and Management // Journal of Clinical Medicine. — 2021-02-02. — В. 3. — том 10. — С. 536. — ISSN 2077-0383. — DOI:10.3390/jcm10030536
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 Stanley, M., Killeen, R. B., & Michalski, J. M. (2023). Thrombotic Thrombocytopenic Purpura. In StatPearls. StatPearls Publishing.
- ↑ 5,0 5,1 5,2 5,3 5,4 Johanna A. Kremer Hovinga, Paul Coppo, Bernhard Lämmle, Joel L. Moake, Toshiyuki Miyata, Karen Vanhoorelbeke Thrombotic thrombocytopenic purpura англ. // Nature Reviews Disease Primers. — 2017-04-06. — В. 1. — том 3. — ISSN 2056-676X. — DOI:10.1038/nrdp.2017.20
- ↑ 6,0 6,1 Atrash, S., Sajjad, H., Jeanette, R., & Konstantinos, A. (2015). Thrombotic thrombocytopenic purpura. The Journal of the Arkansas Medical Society, 111(9), 187–189.
- ↑ X. Long Zheng, Sara K. Vesely, Spero R. Cataland, Paul Coppo, Brian Geldziler, Alfonso Iorio, Masanori Matsumoto, Reem A. Mustafa, Menaka Pai, Gail Rock, Lene Russell, Rawan Tarawneh, Julie Valdes, Flora Peyvandi ISTH guidelines for treatment of thrombotic thrombocytopenic purpura // Journal of Thrombosis and Haemostasis. — 2020-10. — В. 10. — том 18. — С. 2496–2502. — ISSN 1538-7836. — DOI:10.1111/jth.15010
Литература[править]
- Галстян Геннадий Мартинович, Клебанова Елизавета Евгеньевна, Мамлеева Светлана Юрьевна и другие Иммунная тромбоцитопеническая пурпура и тромботическая тромбоцитопеническая пурпура — сложности и ошибки диагностики // Гематология и трансфузиология. — 2023. — № 3. — DOI:10.35754/0234-5730-2023-68-3-317-334
- Рукавицын О. А. (ред.). Гематология: национальное руководство. — 2-е изд., перераб.. — Москва: ГЭОТАР-Медиа, 2024. — С. 920. — ISBN 978-5-9704-8188-2.
- Галстян Геннадий Мартинович, Клебанова Елизавета Евгеньевна, Мамлеева Светлана Юрьевна, Федорова Светлана Юрьевна, Дроков Михаил Юрьевич, Яцык Галина Александровна Неврологические нарушения у пациентов с тромботической тромбоцитопенической пурпурой // Клиническая медицина. — 2023. — № 1. — DOI:10.30629/0023-2149-2023-101-1-41-49
Шаблон:Кровотечения и нарушения свёртываемости крови
Одним из источников, использованных при создании данной статьи, является статья из википроекта «Рувики» («ruwiki.ru») под названием «Тромботическая тромбоцитопеническая пурпура», расположенная по адресу:
Материал указанной статьи полностью или частично использован в Циклопедии по лицензии CC-BY-SA 4.0 и более поздних версий. Всем участникам Рувики предлагается прочитать материал «Почему Циклопедия?». |