Циклопропан
| Циклопропан | |

| |
| |
| |
| Общие | |
|---|---|
| Химическая формула | C3H6 |
| Физические свойства | |
| Состояние | бесцветный газ, со специфическим запахом нефти |
| Молярная масса | 42,0797 ± 0,0028 г/моль |
| Плотность | 1,879 г/л (при н. у.) г/см³ |
| Термические свойства | |
| Т. плав. | −127,62 |
| Т. кип. | −32,86 °C |
| Т. свспл. | 555 °C |
| Кр. точка | 397,80 |
| Химические свойства | |
| Растворимость в воде | 0,502 г/100 мл |
| Классификация | |
| Рег. номер CAS | 75-19-4 |
| Рег. номер PubChem | 6351 |
| SMILES | C1CC1 |
| Безопасность | |
| Токсичность | слаботоксичен, имеет наркотические свойства |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Циклопропан (триметилен) C3H6 — простейшее органическое соединение с кольцевой структурой, образованное из углерода и водорода. Структурно относится к группе циклоалканов. Его номер CAS 75-19-4. Циклопропан — бесцветный, легковоспламеняющийся газ со сладким запахом.
История[править]
Циклопропан был открыт в 1881 году Августом Фройндом, который также представил его правильную структуру в опубликованной им статье. Он получил его путем реакции 1,3-дибромпропана с натрием, что привело к внутримолекулярной реакции Вюрца, и непосредственно произвел циклопропан. Г. Густавсон улучшил выход реакции, используя цинк вместо натрия. До изобретения анестезирующих свойств циклопропана в 1929 году он не имел коммерческого использования. Промышленное производство началось к 1936 году.
Структура[править]
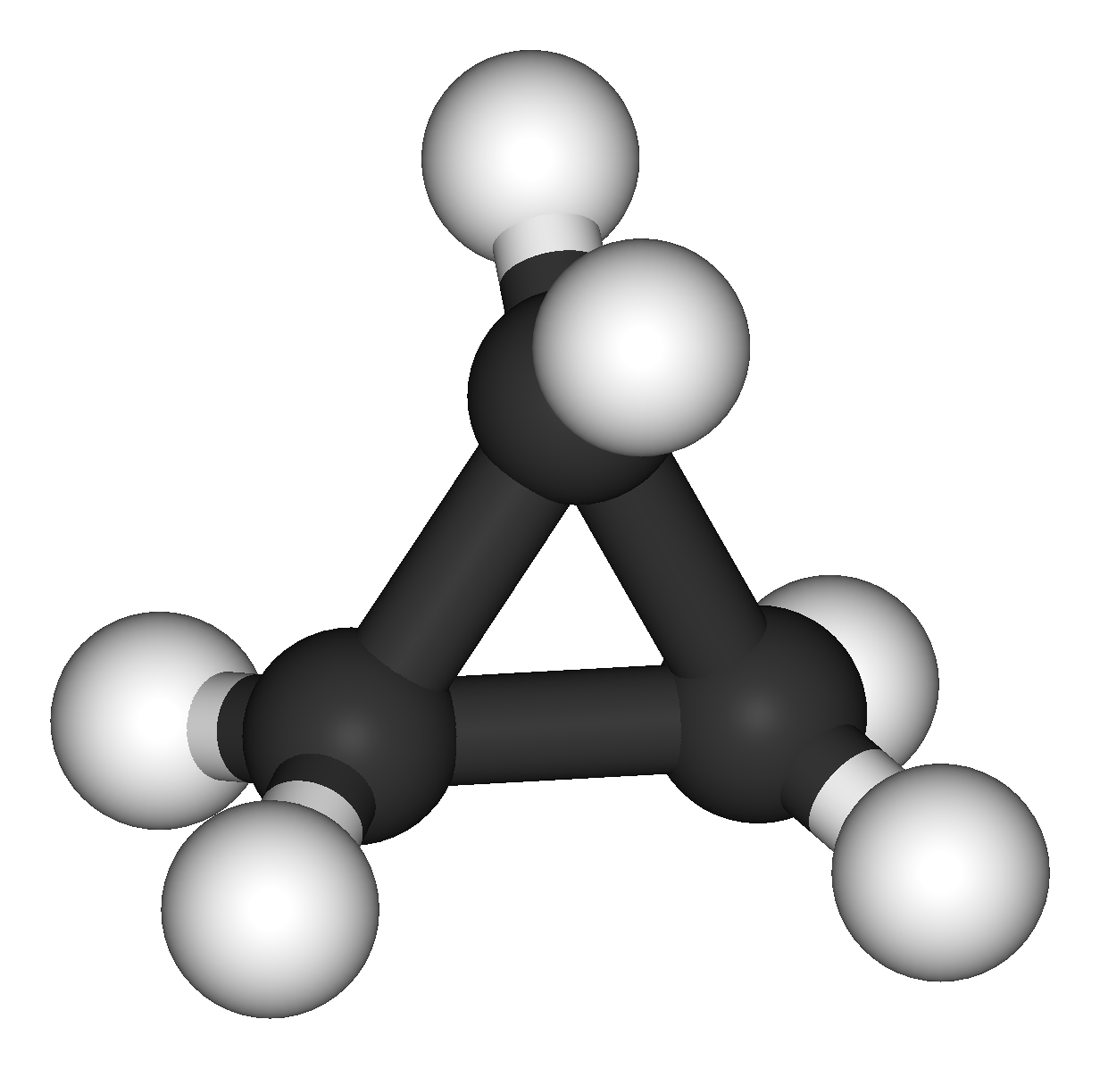
В циклопропане атомы углерода образуют равносторонний треугольник. Таким образом, циклопропан планарен по отношению к своим атомам углерода. Углы в 60° между атомами углерода сильно отличаются от тенденции четырехвалентного углерода образовывать углы около 109°, поэтому циклопропан имеет большое угловое напряжение. Угловое напряжение можно обнаружить с помощью измерений электронной плотности в рентгеновских лучах, которые показывают изгиб ковалентных связей между атомами углерода. Напряженные связи делают циклопропан более реактивным, чем обычный алкан. Циклопропан медленно превращается в пропилен.
Подготовка и реакции[править]
Циклопропан получают из 1,3-дихлорпропана с цинком и йодидом натрия. Для него характерны реакции, в которых раскрывается его реангасная структура. Это тот случай, когда он реагирует, среди прочего, с бромом, гидробромидом, водородом и серной кислотой. Соединение может быть использовано в органическом синтезе.
Использование[править]
Циклопропан использовался в медицине для ингаляционной анестезии, среди прочего, потому, что он эффективен и только умеренно токсичен. От его использования отказались, поскольку смесь циклопропана и воздуха очень взрывоопасна и может также вызвать сердечную аритмию.
Ссылки[править]
↑ [+] | |
|---|---|
| Алканы |
Метан • Этан • Пропан • Бутан • Пентан (Изопентан) (Неопентан) • Гексан • Гептан • Октан • Нонан • Декан • Ундекан • Додекан • Тридекан • Тетрадекан • Пентадекан • Гексадекан • Гептадекан • Октадекан • Нонадекан • Пристан • Эйкозан • Генэйкозан • Докозан • Тетракозан • Гентриаконтан • Гектан |
| Алкены |
Этилен • Пропен • Бутены • Пентены • Гексены • Гептены • Октен |
| Алкины | |
| Диены | |
| Другие ненасыщенные | |
| Циклоалканы |
Циклопропан • Циклобутан • Циклопентан • Циклогексан • Циклогептан • Циклооктан • Циклононан • Циклодекан • Циклоундекан • Циклододекан • Циклотридекан • Циклотетрадекан • Циклопентадекан |
| Ароматические |
Бензол • Толуол • Диметилбензолы • Этилбензол • Пропилбензол • Кумол • Стирол • Фенилацетилен • Дифенил • Дифенилметан • Трифенилметан • Тетрафенилметан |
| Полициклические | |
| Полициклические ароматические |
Нафталин • Антрацен • Бензантрацен • Пентацен • Фенантрен • Пирен • Бензпирен • Азулен • Хризен • Инден • Индан |