Гемодиализ-ассоциированный амилоидоз
Диализ-ассоциированный амилоидоз (ДАА; бета-2-микроглобулиновый амилоидоз) представляет собой тип амилоидоза, поражающий пациентов, находящихся на длительном гемодиализе. Заболевание развивается вследствие отложения бета-2-микроглобулина в форме амилоидных фибрилл, которые преимущественно накапливаются в костно-суставных структурах. Наиболее частыми локализациями поражения являются плечевые, лучезапястные, тазобедренные и коленные суставы, а также позвоночник[1].
История[править]
История изучения ДАА началась с того, что синдром запястного канала (СЗК) у пациентов на гемодиализе был впервые описан, когда метод гемодиализа уже применялся около 15 лет. В 1980 году было установлено, что у диализных пациентов с СЗК в синовиальной оболочке присутствуют амилоидные отложения, и синдром стал рассматриваться как проявление амилоидоза. В 1984 году была продемонстрирована связь между болью и тугоподвижностью плеча, операциями по поводу СЗК и выявлением амилоидных отложений. Тогда же был описан новый специфический синдром — деструктивная спондилоартропатия у пациентов на гемодиализе, главной причиной которой также считался ДАА. В 1985 году основным белковым компонентом этого амилоида был идентифицирован бета-2-микроглобулин с молекулярной массой 12,000 дальтон[2].
Этиология[править]
В основе ДАА лежит накопление бета-2-микроглобулина (β2M) в виде токсичных амилоидных фибрилл в костно-мышечной системе пациентов с почечной недостаточностью. β2M-амилоид вызывают хроническую артропатию и другие серьёзные осложнения. β2M представляет собой белок с молекулярной массой 11.8 кДа, имеющий иммуноглобулин-подобную структуру. Он является лёгкой цепью молекул главного комплекса гистосовместимости класса I[3].
ДАА развивается на фоне проведения как почечного, так и перитонеального диализа. К факторам риска развития ДАА относятся[4]:
- длительность лечения диализом: развитие ДАА напрямую зависит от продолжительности диализной терапии. Совершенствование методов диализа увеличивает выживаемость пациентов, что, в свою очередь, повышает развития этого осложнения;
- возраст начала гемодиализа: пожилые пациенты более подвержены риску развития ДАА по сравнению с молодыми;
- отсутствие остаточной функции почек: поскольку β2M выводится путём клубочковой фильтрации с последующей реабсорбцией и катаболизмом в проксимальных канальцах, снижение функции почек и потеря остаточной функции приводят к прогрессирующему повышению уровня β2M в плазме;
- использование низкопоточных диализных мембран;
- использование биологически несовместимых мембран: мембраны из купрофана и ацетата целлюлозы имеют малые поры и не способны очищать кровь от веществ с молекулярной массой выше 200 Да. Контакт моноцитов с такими мембранами стимулирует выработку интерлейкина-6 и повышает выработку β2M. Это усугубляет воспалительный ответ и окислительный стресс, способствуя развитию амилоидоза.
Патогенез[править]
β2M присутствует на поверхности большинства ядросодержащих клеток и в большинстве биологических жидкостей. Он циркулирует в виде несвязанного мономера, распределённого во внеклеточном пространстве. В нормально функционирующей почке β2M удаляется путём клубочковой фильтрации и катаболизируется в проксимальных канальцах. При почечной недостаточности нарушение почечного катаболизма вызывает увеличение синтеза и высвобождения β2M, и его уровень может повышаться в 10-60 раз. Задержка и накопление этого белка считается основным патогенетическим процессом, лежащим в основе бета-2m-амилоидоза. Существуют также предположения, что сам процесс диализа может стимулировать синтез β2M за счёт активации комплемента и выработки цитокинов[5].
Нарушение архитектуры тканей вследствие отложения амилоида традиционно рассматривается как основной механизм дисфункции органов при ДАА. Однако ряд исследователей предполагает, что сами амилоидогенные белки-предшественники, промежуточные формы их сворачивания и протофибриллы обладают независимой токсичностью, не связанной с образованием амилоидных депозитов, и также вносят вклад в клинические проявления заболевания[4].
Эпидемиология[править]
Согласно исследованиям, ДАА может наблюдаться у 20% пациентов уже после 2-4 лет гемодиализа и практически у 100% пациентов после 13 лет лечения. Однако точная распространённость ДАА остаётся невыясненной[5].
Диагностика[править]
Клиническая картина[править]
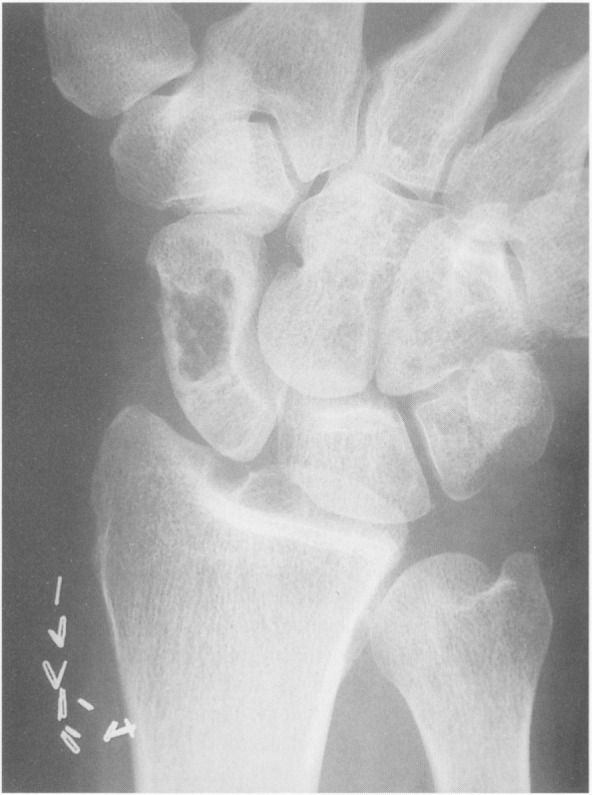
СЗК является одним из основных и относительно ранних клинических проявлений ДАА. Отложение амилоида в сухожильных влагалищах и синовиальных оболочках карпального канала вызывает теносиновит, что приводит к компрессии срединного нерва. СЗК может развиться в течение 3-5 лет после начала диализной терапии. Его распространённость прогрессивно возрастает, достигая почти 100% после более чем 20 лет гемодиализа. Клинические проявления СЗК включают: парестезии ладонной поверхности первых 3-4 пальцев с последующим развитием сенсорных нарушений, мышечной слабости и атрофии. Боль характерно усиливается в ночное время и во время сеансов гемодиализа. Со временем процесс часто становится двусторонним[2].
Для пациентов с ДАА также характерно развитие теносиновита сгибателей — это расстройство, часто называемое «щёлкающим пальцем» или «пружинящим пальцем». Пациенты могут сгибать палец, но при разгибании может ощущаться болезненный щелчок, который иррадиирует в тыльную сторону кисти[5].
Лопаточно-плечевая артропатия при ДАА возникает, когда амилоид откладывается в области вращательной манжеты плеча и вокруг неё, что приводит к боли в плече, усиливающейся в положении лёжа на спине. Пациенты часто сообщают о трудностях при одевании. Спондилоартропатия при ДАА чаще всего поражает шейный отдел позвоночника, и пациенты обычно жалуются на боль в шее и спине[5].
При ДАА также возможны системные проявления[5]:
- поражение желудочно-кишечного тракта проявляется макроглоссией, дисфагией, ишемией тонкого кишечника, мальабсорбцией и псевдообструкцией толстой кишки;
- со стороны сердечно-сосудистой системы возможно вовлечение миокарда, перикарда и клапанов сердца с развитием сердечной недостаточности;
- дерматологические проявления встречаются крайне редко, однако описаны подкожные узлы, лихеноидные бляшки и участки гиперпигментации.
Инструментальная диагностика[править]
Рентгенография скелета: характерно выявление кист в головках бедренных костей, плечевых костях, надколенниках, вертлужных впадинах и позвоночнике[6].
Компьютерная томография скелета: позволяет идентифицировать псевдоопухолевые образования и псевдокистозные участки в околосуставной костной ткани. Кроме того, томография является наиболее эффективным методом для обнаружения небольших зон остеолиза в кортикальном слое кости или костной эрозии и может быть полезной для оценки распределения и масштабов деструктивных изменений[5].
Магнитно-резонансная томография позвоночника: полезна для дифференциации деструктивных спондилоартропатий от воспалительных процессов и инфекций[5].
Ультразвуковое исследование суставов: характерно утолщение суставных капсул (особенно тазобедренного и коленного суставов) и скопление синовиальной жидкости[5].
Морфологическое исследование: характерно яблочно-зелёное двойное лучепреломление амилоида при окраске конго красным. В качестве материала используется биоптат кистозных опухолей костей либо синовиальную жидкость из поражённых суставов[5].
Дифференциальная диагностика[править]
Дифференциальная диагностика АА-амилоидоза проводится со следующими состояниями[7]:
- семейный амилоидоз с поражением почек;
- AL-амилоидоз;
- транстиретиновая семейная амилоидная полинейропатия
- AA-амилоидоз
- мастоцитоз.
Лечение[править]
Трансплантация почки является оптимальным методом заместительной почечной терапии. Однко, большинство пациентов с терминальной почечной недостаточностью не являются подходящими кандидатами для трансплантации из-за сопутствующих заболеваний, пожилого возраста и длительности диализа. Кроме того, дефицит донорских почек делает трансплантацию труднодоступным вариантом лечения. Поэтому, посколько этиологического медикаментозного или фармакологического лечения ДАА не существует, удаление плазменного β2M во время сеансов диализа остаётся краеугольным камнем лечения этого заболевания[4][5]
Паллиативное лечение ДАА направлено на уменьшение симптомов, связанных с заболеванием. Наиболее инвалидизирующими клиническими проявлениями являются СЗК и склонность к патологическим переломам из-за костных кист. С целью терапии суставной и костной боли могут быть использованы анальгетики, нестероидные противовоспалительные препараты и глюкокортикостероиды[4][5].
Хирургическая коррекция СЗК с удалением гипертрофированной синовиальной оболочки, инфильтрированной амилоидом, эффективно снижает компрессию срединного нерва. Лопаточно-плечевой периартрит часто требует артроскопической или открытой операции по удалению синовиальной оболочки, инфильтрированной β2M. Костная пластика участков с амилоидными кистами или замена поражённых суставов полезны для облегчения боли и восстановления подвижности[4][5].
Прогноз[править]
Прогноз при ДАА остаётся сложным, несмотря на значительный прогресс в методах гемодиализа. Пациенты с меньшим бременем сопутствующих заболеваний, которые не являются кандидатами на трансплантацию почки, имеют более благоприятный прогноз[8].
Диспансерное наблюдение[править]
Не разработано.
Профилактика[править]
Для профилактики и замедления прогрессирования ДАА у пациентов на гемодиализе необходимо оптимизировать лечение с целью достижения максимального снижения уровня плазменного β2M за счёт его эффективного клиренса. Эффективность удаления этого белка напрямую зависит от модальности диализа, его продолжительности и частоты проведения процедур[4].
Примечания[править]
- ↑ Fukuda K., Yamamoto H. Dialysis-related amyloidosis англ. // Seminars in Musculoskeletal Radiology. — 2001. — том 5. — № 2. — С. 113-119. — DOI:10.1055/s-2001-15879
- ↑ 2,0 2,1 Yamamoto S., Gejyo F. Historical background and clinical treatment of dialysis-related amyloidosis англ. // Biochimica et Biophysica Acta. — 2005. — том 1753. — № 1. — С. 4-10. — DOI:10.1016/j.bbapap.2005.09.006
- ↑ Mehta D., Singh H., Haridas V., Chaudhuri T.K. Molecular Insights into the Inhibition of Dialysis-Related β2m Amyloidosis Orchestrated by a Bispidine Peptidomimetic Analogue англ. // Biochemistry. — 2022. — том 61. — № 14. — С. 1473-1484. — DOI:10.1021/acs.biochem.2c00205
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 Scarpioni R., Ricardi M., Albertazzi V. et al. Dialysis-related amyloidosis: challenges and solutions англ. // International Journal of Nephrology and Renovascular Disease. — 2016. — том 9. — С. 319-328. — DOI:10.2147/IJNRD.S84784
- ↑ 5,00 5,01 5,02 5,03 5,04 5,05 5,06 5,07 5,08 5,09 5,10 5,11 Basu A., Batuman V. Beta-2 Microglobulin Amyloidosis англ. // Medscape. — 2025.
- ↑ А. В. Смирнов Амилоидоз у больных с хронической почечной недостаточностью, получающих лечение гемодиализом // Нефрология. — 1997. — № 2.
- ↑ Bustamante J.G., Zaidi S.R.H. Amyloidosis англ. // StatPearls. — 2023.
- ↑ Portales-Castillo I., Yee J., Tanaka H., Fenves A.Z. Beta-2 Microglobulin Amyloidosis: Past, Present, and Future англ. // Kidney360. — 2020. — том 1. — № 12. — С. 1447-1455. — DOI:10.34067/KID.0004922020
Литература[править]
- Беликова А. Т., Брин В. Б., Козырев К. М. Функционально-морфологическая характеристика экспериментального генерализованного амилоидоза нефропатического типа // Вестник новых медицинских технологий. — 2011. — № 2.
- Бичурина Д. М., Чернова Ю. В. Характеристика пациентов с системным амилоидозом // Бюллетень медицинских интернет-конференций. — 2013. — № 2.
Одним из источников, использованных при создании данной статьи, является статья из википроекта «Рувики» («ruwiki.ru») под названием «Гемодиализ-ассоциированный амилоидоз», расположенная по адресу:
Материал указанной статьи полностью или частично использован в Циклопедии по лицензии CC-BY-SA 4.0 и более поздних версий. Всем участникам Рувики предлагается прочитать материал «Почему Циклопедия?». |