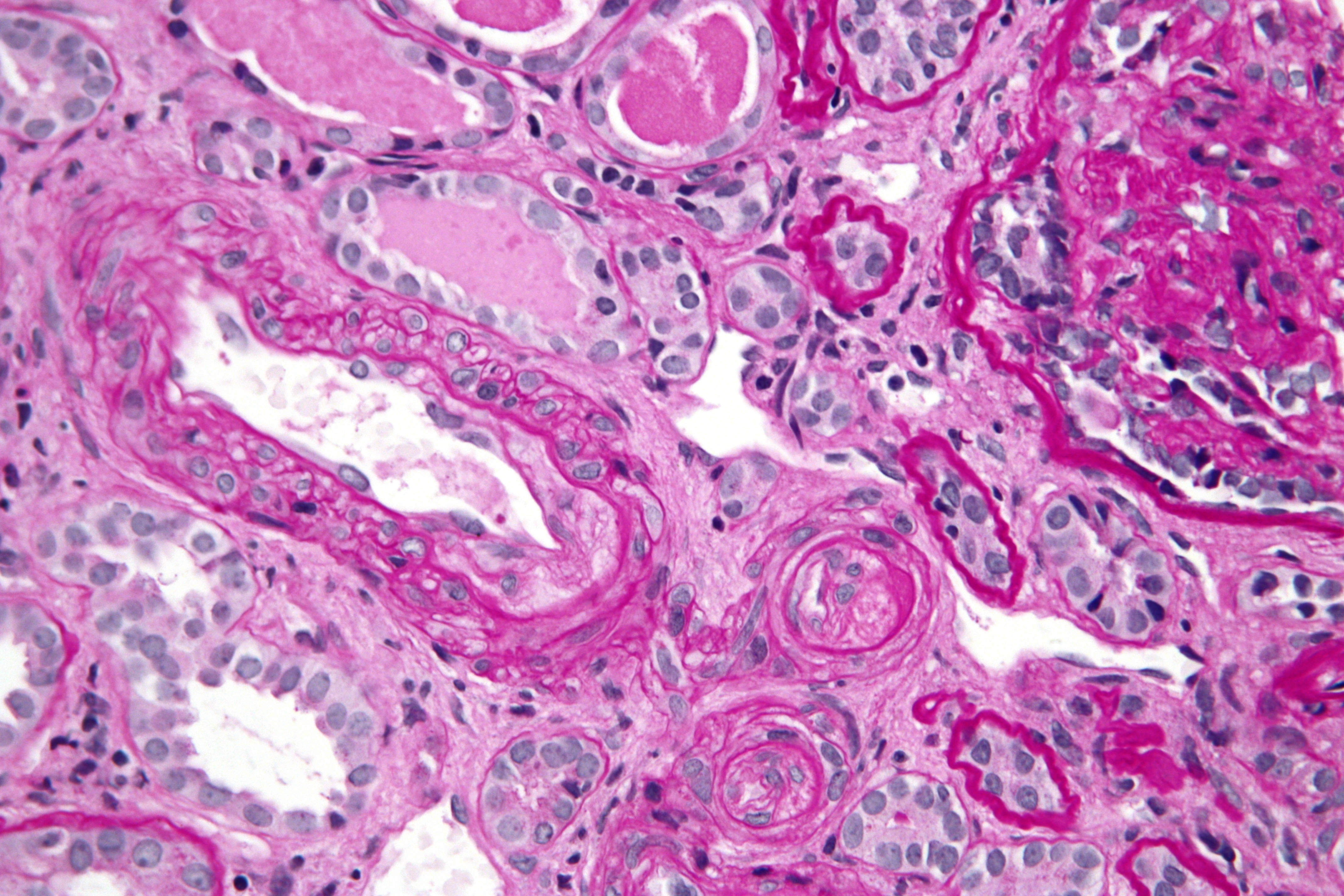
Тромботическая микроангиопатия
Тромботические микроангиопатии — группа различных заболеваний, которые приводят к закупорке мелких или крупных сосудов из-за тромбов. Их основные признаки: разрушение эритроцитов, снижение количества тромбоцитов и повреждение органов из-за недостатка кровоснабжения.
Эти болезни опасны и могут вызывать серьёзные осложнения [1].
История[править]
В 1924 году, доктор Эли Московиц опубликовал ключевое описание случая пациента, скончавшегося от неизвестного на тот момент острого заболевания, которое сегодня известно как тромботическая тромбоцитопеническая пурпура (ТТП). При вскрытии были обнаружены распространённые гиалиновые микротромбы в капиллярах и артериолах множества органов, особенно сердца, селезёнки и почек.
В 1947 году Зингер и его коллеги детально описали случай, схожий с пациентом Московица, с аналогичными микротромбами в различных органах. Проанализировав все известные на тот момент похожие случаи, они предположили существование отдельного патологического состояния. Зингер и соавторы противопоставили его «идиопатической тромбоцитопенической пурпуре» и предложили название «тромботическая тромбоцитопеническая пурпура».
В 1966 году Аморози и Ультманн провели масштабный обзор всех зарегистрированных на тот момент случаев ТТП. Они выделили пять диагностических критериев:
- микроангиопатическая гемолитическая анемия с фрагментацией эритроцитов (шистоциты, клетки-шлемы);
- тромбоцитопения потребления;
- неврологические нарушения;
- поражение почек;
- лихорадка.
Авторы задались вопросом о природе «гиалиновых» микротромбов, отметив почти стопроцентную летальность среди пациентов и неэффективность существующих методов лечения.
В 1982 году Моак и его коллеги обнаружили в плазме пациентов с хронической рецидивирующей ТТП аномально крупные мультимеры фактора фон Виллебранда. Они предположили, что эти мультимеры, присутствующие в период ремиссии, играют ключевую роль в агрегации тромбоцитов во время острой фазы, исчезая из плазмы в момент приступа.
В 1996 году две независимые группы исследователей сообщили об открытии новой металлопротеазы в плазме человека, способной избирательно расщеплять фактор фон Виллебранда. В 2001 году три научные группы очистили этот фермент до гомогенного состояния, что позволило изучить его аминокислотный состав. Исследователи отнесли протеазу к семейству ADAMTS, присвоив название ADAMTS13 [2].
Классификация[править]
Классификация тромботической микроангиопатии (ТМА) базируется на этиологии и патофизиологических механизмах развития процесса. В понятие ТМА входят следующие состояния:
- тромботическая тромбоцитопеническая пурпура;
- гемолитико-уремический синдром;
- ТМА ассоциированная с сопутствующими состояниями и заболеваниями (злокачественные новообразования, гипертоническая болезнь, состояние после трансплантации органов, беременность и приём препаратов);
- атипичный гемолитико-уремический синдром с генетическими нарушениями или без них [3]
Этиология и патогенез[править]
Тромботическая тромбоцитопеническая пурпура
ТТП развивается из-за недостаточной активности протеазы ADAMTS13, которая расщепляет фактор фон Виллебранда. В норме этот фермент разрушает сверхкрупные мультимеры фактора фон Виллебранда, обладающие высокой тромбогенной активностью в нерасщеплённом состоянии. При дефиците ADAMTS13 эти мультимеры накапливаются в крови и служат основой для избыточной агрегации тромбоцитов. Это приводит к неконтролируемому тромбообразованию в мелких сосудах и гемолизу. В большинстве случаев ТТП вызвана аутоантителами класса IgG, блокирующими ADAMTS13. Наследственная (врождённая) форма ТТП, известная как синдром Апшоу-Шульмана, возникает из-за мутаций в гене ADAMTS13 (гомозиготных или компаунд-гетерозиготных) [3].
Гемолитико-уремический синдром
Гемолитико-уремический синдром (ГУС), связанный с шига-токсином, развивается как тяжёлое осложнение при кишечных инфекциях, вызванных бактериями, вырабатывающими шига-токсин, в основном энтерогеморрагической кишечной палочкой. Шига-токсин попадает в кровь, связываясь с рецептором глоботриаозилцерамидом-3 на поверхности клеток, после чего проникает в эндотелий мелких сосудов и другие ткани, имеющие этот рецептор. Основное повреждение происходит в почечных и кишечных эндотелиальных клетках, что и вызывает основные симптомы болезни, но также могут поражаться центральная нервная система, поджелудочная железа и другие органы, что определяет тяжесть и исход заболевания. Наиболее часто ГУС ассоциирован с серотипом Esherichia coli O157:H7, но другие бактерии вроде Shigella dysenteriae, тоже способны вызывать это состояние. Известы также случаи ГУС, вызванные вирусными инфекциями [3].
Атипичный гемолитико-уремический синдром
Атипичный ГУС представляет собой хроническое генетически обусловленное заболевание, в основе которого лежит неконтролируемая активация альтернативного пути комплемента, приводящая к системному тромбообразованию в микрососудах (комплемент-опосредованная тромботическая микроангиопатия). Развитие заболевания связано с генетическими дефектами регуляторных белков комплемента, включая фактор H (CFH), мембранный кофакторный белок (MCP/CD46), фактор I (CFI) и тромбомодулин (THBD), а также нарушением компонентов С3-конвертазы (С3 и фактор B). Эти мутации приводят к нарушению защиты эндотелиальных клеток от активации системы комплемента, вызывая их повреждение и последующее образование тромбов в микроциркуляторном русле. Характерное преимущественное поражение почек при атипичном ГУС объясняется особенностями строения эндотелия клубочковых капилляров, который обладает повышенной чувствительностью к повреждению, связанному с нарушениями регуляции комплемента [4].
ТМА также ассоциирован со следующими состояниями:
- злокачественные новообразования: у онкологических больных ТМА развивается на фоне активации системы гемостаза, вызванной опухолевым ростом. Основные механизмы включают повреждение эндотелия, активацию тромбоцитов, выработку прокоагулянтов и подавление фибринолиза, что приводит к микротромбозам. Особенно часто ТМА встречается при муцин-продуцирующих аденокарциномах (желудка, молочной железы, яичников и др.), а также при распространённых метастатических опухолях [5].
- беременность: при беременности ТМА может быть обусловлена тяжёлой преэклампсией и HELLP-синдромом. Более того, впервые атипичный ГУС и ТТП могут манифестировать во время беременности. Этими факторами затрудняется дифференциальная диагностика ТМА при беременности [6].
- трансплантация органов: в процессе трансплантации различные факторы приводят к развитию эндотелиита с последующей активацией системы комплемента, образованием тромбоцитарных тромбов и микроангиопатической гемолитической анемией, что в конечном итоге вызывает дисфункцию органов-мишеней. В каскаде патогенетических механизмов важную роль играют исходная предрасположенность к активации комплемента или предшествующее повреждение эндотелия и дополнительные повреждающие факторы (лекарственные препараты, аллореактивность, инфекции). Накопление этих трёх компонентов преодолевает определённый порог, запуская каскад активации комплемента и образование микротромбов [7].
- злокачественная артериальная гипертензия: предполагается, что экстремальное повышение артериального давления, характерное для злокачественной гипертензии, вызывает прямое повреждение сосудистого эндотелия. Это запускает патогенетические процессы, характерные для ТМА: агрегацию тромбоцитов с окклюзией сосудистого просвета, что приводит к органной дисфункции и механической анемии, вызванной разрушением эритроцитов при столкновении с тромбоцитарными тромбами [8].
- патогенетические механизмы ТМА при приёме антибиотиков, иммуносупрессантов, цитостатиков и других препаратов отличаются значительной гетерогенностью и до конца не изучены. В настоящее время их принято разделять на два основных типа. Первый тип иммуноопосредованные механизмы, при которых происходит образование реактивных аутоантител, взаимодействующих с эндотелиальными клетками, тромбоцитами или циркулирующими факторами крови. Второй тип неиммунные механизмы, связанные с прямой эндотелиальной токсичностью, реализуемой через различные патогенетические пути [9].
- аутоиммунные заболевания: ТАМ ассоциирован с системной красной волчанкой, синдромом Шегрена, системной склеродермией, антифосфолипидным синдромом. Патогенез до конца не ясен, однако, предполагается аутоиммунное поражение эндотелиальных клеток, что ведёт в развитию ТМА [9][10]
Эпидемиология[править]
ТТП относится к редким заболеваниям с распространённостью от 1 до 13 случаев на 1 млн населения, варьирующейся в зависимости от региона. Пик заболеваемости приходится на возраст после 40 лет, хотя врождённые формы встречаются у детей. Для ТТП характерно преобладание среди женщин (соотношение 2:1) [11].
ГУС и его атипичная форма преимущественно поражают детей младше 10 лет, при этом около 75% случаев регистрируется у детей до 5-летнего возраста. Эпидемиологические исследования показывают, что общая заболеваемость ГУС на фоне инфекции кишечной палочкой составляет 0.57 случаев на 100 000 детей, достигая максимума (3 случая на 100 000) в группе детей от 6 месяцев до 2 лет. В отличие от типичного ГУС, атипичная форма встречается значительно реже (2-9 случаев на 1 миллион лиц моложе 20 лет), но характеризуется более тяжёлым течением и высокой летальностью, также преимущественно поражая детей до 5 лет. Особняком стоит пневмококковый аГУС, который чаще возникает в зимний период [12].
Диагностика[править]
Клинические проявления ТМА весьма вариабельны и зависят от типа заболевания. Однако можно выделить общие черты:
- анемия – обычно носит гемолитический характер, проявляется бледностью, слабостью, одышкой при нагрузке. Часто выявляется при лабораторном обследовании;
- тромбоцитопения – сопровождается петехиальной сыпью, экхимозами, носовыми и десневыми кровотечениями, меноррагиями у женщин;
- почечное повреждение – от протеинурии и микрогематурии до острого повреждения почек с развитием анурии;
- неврологическая симптоматика – могут включать головную боль, нарушение сознания, судороги, инсультоподобные эпизоды;
- лихорадка – отмечается не всегда, чаще при ТТП;
- артериальная гипертензия – часто встречается при ГУС и атипичном ГУС;
- кардиальные симптомы могут варьироваться от безболевой ишемии и инфаркта миокарда, до внезапной сердечной смерти;
- редкими проявлениями ТМА могут быть панкреатит, гепатит, рабдомиолиз, острый респираторный дистресс-синдром, мезентериальная ишемия, гангрена кожи [13].
Лабораторная диагностика
- общий анализ крови: на фоне гемолиза характерны анемия и тробоцитопения;
- микроскопическое исследование мазка крови: характерно наличие шистоцитов;
- коагулограмма: протробминовое время и активированное частичное тромбопластиновое время не повышены;
- биохимический анализ крови: характерно повышение уровня билирубина;
- иммуноферментный анализ крови: возможно снижение концентрации металлопротеазы ADAMTS-13;
- при подозрении на инфаркт миокарда определение концентрации тропонина крови [13].
Инструментальная диагностика
Может потребоваться в случае диагностики поражения органов. Чаще всего используются компьютерная томография, магнитно-резонансная томография и ультразвуковое исследование [13].
Дифференциальная диагностика[править]
При подозрении на ТАМ проводят дифференциальную диагностику со следующими состояниями:
- мегалобластная анемия;
- синдром Эванса;
- пароксизмальная ночная гемоглобинурия;
- септицемия;
- синдром диссеминированного внутрисосудистого свёртывания;
- диффузные болезни соединительной ткани [13]
Лечение[править]
Лечение во многом зависит от типа ТМА:
- при ТТП основным методом лечения является плазмаферез в сочетании с высокими дозами кортикостероидов, которые уменьшают активность ретикулоэндотелиальной системы и снижают выработку аутоантител. В качестве дополнительной терапии при неэффективности лечения первой линии обычно применяют цитостатические препараты (циклоспорин, циклофосфамид, винкристин) и моноклональные антитела (ритуксимаб). Спленэктомия устраняет основной источник продукции антител, однако её эффективность варьируется [11].
- при типичном ГУС терапия преимущественно поддерживающая. Переливание эритроцитарной массы проводят по показаниям, а тромбоцитарную массу используют ограниченно из-за риска тромботических осложнений. Антидиарейные препараты и антибиотики противопоказаны при инфекции Eshericia coli продуцирующей шига-токсин, так как могут ухудшить исход (усиливают воздействие шига-токсина). При дизентерии и пневмококковой инфекции проводится терапия антибиотиками [12].
- лечение атипичного ГУС требует экстренного вмешательства для предотвращения терминальной почечной недостаточности и летального исхода. Терапия первой линии — экулизумаб (моноклональное антитело к С5-компоненту комплемента),терапия второй линии — плазмаферез [12].
Прогноз[править]
Прогноз зависит от этиологической причины, вызвавшей ТМА:
- ТТП без лечения приводит к летальному исходу в 90% случаев, однако своевременно начатая терапия позволяет снизить смертность до 15%. Основными причинами смерти при ТТП являются тромбоз коронарных артерий с последующим развитием острого инфаркта миокарда, застойная сердечная недостаточность и внезапная сердечная смерть [11]
- при типичном ГУС в целом прогноз благоприятный с летальностью около 5%. Однако у 25% пациентов развиваются отдалённые осложнения: снижение скорости клубочковой фильтрации, гипертензия или протеинурия, что повышает риск развития и прогрессирования почечной недостаточности с возрастом. Наиболее значимый прогностический фактор — длительность диализа: осложнения вероятны при необходимости диализа более 2–3 недель [12].
- течение аГУС было значительно тяжелее по сравнению с типичной формой. Однако применение экулизумаба снизило частоту развития терминальной почечной недостаточности и смерти: у детей: с 30–50% до 9%, а у взрослых: с 60% до 6–15% [12]
Прогноз при вторичной ТМА на фоне сопутствующего заболевания определяется динамикой развития основного процесса, вызвавшего ТМА.
См.также[править]
Примечания[править]
- ↑ Mouhamed Yazan Abou‐Ismail, Sargam Kapoor, Divyaswathi Citla Sridhar, Lalitha Nayak, Sanjay Ahuja Thrombotic microangiopathies: An illustrated review // Research and Practice in Thrombosis and Haemostasis. — 2022-03. — В. 3. — том 6. — С. e12708. — ISSN 2475-0379. — DOI:10.1002/rth2.12708
- ↑ Alexander Vorobev, Victoria Bitsadze, Fidan Yagubova, Jamilya Khizroeva, Antonina Solopova, Maria Tretyakova, Nilufar Gashimova, Kristina Grigoreva, Sabina Einullaeva, Maria Drozhzhina, Aygun Hajiyeva, Emilia Khalilulina, Alexander Cherepanov, Daredzhan Kapanadze, Elena Egorova, Nart Kuneshko, Jean-Christophe Gris, Ismail Elalamy, Cihan Ay, Alexander Makatsariya The Phenomenon of Thrombotic Microangiopathy in Cancer Patients // International Journal of Molecular Sciences. — 2024-08-21. — В. 16. — том 25. — С. 9055. — ISSN 1422-0067. — DOI:10.3390/ijms25169055
- ↑ 3,0 3,1 3,2 Philip A. McFarlane, Martin Bitzan, Catherine Broome, Dana Baran, Jocelyn Garland, Louis-Philippe Girard, Kuljit Grewal, Anne-Laure Lapeyraque, Christopher Jordan Patriquin, Katerina Pavenski, Christoph Licht Making the Correct Diagnosis in Thrombotic Microangiopathy: A Narrative Review // Canadian Journal of Kidney Health and Disease. — 2021-01. — том 8. — ISSN 2054-3581. — DOI:10.1177/20543581211008707
- ↑ Крутиков Е. С., Белоцерковская Е. Н., Цветков В. А., Польская Л. В., Полищук Т. Ф. Атипичный гемолитико-уремический синдром: клинико-лабораторные диагностические подходы // Таврический медико-биологический вестник. — 2015. — № 4.
- ↑ Макацария А.Д., Элалами И., Воробьев А.В., Бахтина А.С., Мэн М., Бицадзе В.О., Хизроева Д.Х. Тромботическая микроангиопатия у онкологических больных // Вестник Российской академии медицинских наук. - 2019. - Т. 74. - №5. - C. 323-332. doi: 10.15690/vramn1204
- ↑ Игнатко И.В., Тимохина Е.В. Тромботическая микроангиопатия как проявление тяжелой преэклампсии (русский) // Акушерство и гинекология : статья. — Москва, Россия: 2018. — № 1-2 (12).
- ↑ Joanna A. Young, Christopher R. Pallas, Mary Ann Knovich Transplant-associated thrombotic microangiopathy: theoretical considerations and a practical approach to an unrefined diagnosis англ. // Bone Marrow Transplantation. — 2021-04-19. — В. 8. — том 56. — С. 1805–1817. — ISSN 0268-3369. — DOI:10.1038/s41409-021-01283-0
- ↑ Teresa Cavero, Pilar Auñón, Fernando Caravaca-Fontán, Hernando Trujillo et all. Thrombotic microangiopathy in patients with malignant hypertension // Nephrology Dialysis Transplantation. — 2022-08-24. — В. 5. — том 38. — С. 1217–1226. — ISSN 0931-0509. — DOI:10.1093/ndt/gfac248
- ↑ 9,0 9,1 Joshua Leisring, Sergey V. Brodsky, Samir V. Parikh Clinical Evaluation and Management of Thrombotic Microangiopathy // Arthritis & Rheumatology. — 2023-11-30. — В. 2. — том 76. — С. 153–165. — ISSN 2326-5191. — DOI:10.1002/art.42681
- ↑ Nihal Martis, Matthieu Jamme, Corinne Bagnis-Isnard et all. Systemic autoimmune disorders associated with thrombotic microangiopathy: A cross-sectional analysis from the French National TMA registry: Systemic autoimmune disease-associated TMA // European Journal of Internal Medicine. — 2021-11. — том 93. — С. 78–86. — ISSN 0953-6205. — DOI:10.1016/j.ejim.2021.05.040
- ↑ 11,0 11,1 11,2 Stanley, M., Killeen, R. B., & Michalski, J. M. (2023). Thrombotic Thrombocytopenic Purpura. In StatPearls. StatPearls Publishing.
- ↑ 12,0 12,1 12,2 12,3 12,4 Bhandari, J., Rout, P., & Sedhai, Y. R. (2023). Hemolytic Uremic Syndrome. In StatPearls. StatPearls Publishing.
- ↑ 13,0 13,1 13,2 13,3 Филатов Л. Б. Тромботические микроангиопатии // Клиническая онкогематология. Фундаментальные исследования и клиническая практика. — 2008. — № 4.
Литература[править]
- Рукавицын О. А. (ред.). Гематология: национальное руководство. — 2-е изд., перераб.. — Москва: ГЭОТАР-Медиа, 2024. — С. 920. — ISBN 978-5-9704-8188-2.
Шаблон:Кровотечения и нарушения свёртываемости крови
Одним из источников, использованных при создании данной статьи, является статья из википроекта «Рувики» («ruwiki.ru») под названием «Тромботическая микроангиопатия», расположенная по адресу:
Материал указанной статьи полностью или частично использован в Циклопедии по лицензии CC-BY-SA 4.0 и более поздних версий. Всем участникам Рувики предлагается прочитать материал «Почему Циклопедия?». |