Деметилирование
Деметилирование — химический процесс, в результате которого метильная группа (CH3) удаляется из молекулы[1][2]. Распространенный способ деметилирования — это замена метильной группы на атом водорода, что приводит к потере одного атома углерода и двух атомов водорода.
Противоположностью деметилирования является метилирование.
В биохимии[править]
- Файл:DicambaDeMeth.svgДикамба, широко используемый гербицид, биоразлагается путем деметилирования с образованием 3,6-дихлорсалициловой кислоты, катализируемой ферментом диоксигеназой[en].[3]
Деметилирование имеет отношение к эпигенетике. Деметилирование ДНК катализируется деметилазами[en]. Эти ферменты окисляют N-метильные группы, которые встречаются в гистонах, в производных лизина и в некоторых формах ДНК[4].
- R2N-CH3 + O → R2N-H + CH2O
Одним из семейств таких окислительных ферментов является цитохром P450[5]. α-кетоглутаратзависимые гидроксилазы также активны для деметилирования ДНК, действуя по схожей стехиометрии[6]. Эти реакции, протекающие через гидроксилирование, используют несколько ослабленные связи C-H метиламина и метилового эфира.
Деметилирование некоторых стеринов является этапом биосинтеза тестостерона и холестерина. Метильные группы теряются в виде формиата[7].
Переработка биомассы[править]
Метоксильные группы обильно украшают биополимер лигнин. Большой интерес проявляется к превращению этой обильной формы биомассы в полезные химические вещества (помимо топлива). Одним из этапов такой переработки является деметилирование[8][9]. Деметилирование ванилина, производного лигнина, требует 250 °C и сильного основания[10]. Целлюлозно-бумажная промышленность переваривает лигнин с использованием водного сульфида натрия, который частично деполимеризует лигнин. Делигнификация сопровождается обширным O-деметилированием, приводящим к образованию метантиола, который выделяется бумажными фабриками[11].
В органической химии[править]
Деметилирование в органической химии часто относится к разрыву эфирных связей, особенно ароматических эфиров[12].
Исторически ароматические метиловые эфиры, включая природные продукты, такие как кодеин (O-метилморфин), деметилировались нагреванием вещества в расплавленном гидрохлориде пиридина (температура плавления 144 °C) при 180–220 °C, иногда с избытком хлороводорода, в процессе, известном как расщепление эфира Цейзеля-Прея[13][14]. Количественный анализ ароматических метиловых эфиров может быть выполнен аргентометрическим определением образовавшегося N-метилпиридинийхлорида[15]. Механизм этой реакции начинается с переноса протона от пиридиниевого иона к ароматическому метиловому эфиру, что является очень неблагоприятным шагом (K < 10−11), что объясняет жесткие условия, необходимые с учетом значительно более слабой кислотности пиридиния (pKa = 5,2) по сравнению с протонированным ароматическим метиловым эфиром (арилметилоксониевым ионом, pKa = –6,7 для арила = Ph[16]). За этим следует SN2-атака арилметилоксониевого иона на метильную группу пиридином или хлорид-ионом (в зависимости от субстрата) с образованием свободного фенола и, в конечном итоге, N-метилпиридинийхлорида, либо непосредственно, либо путем последующего переноса метила от хлористого метила к пиридину[15].
Другой классический (но, опять же, жесткий) метод удаления метильной группы ароматического метилового эфира заключается в нагревании эфира в растворе бромистого водорода или иодистого водорода, иногда также с уксусной кислотой[17]. Расщепление эфиров бромистым водородом или иодистым водородом происходит путем протонирования эфира с последующим вытеснением бромидом или иодидом. Немного более мягкий набор условий использует циклогексилиодид (CyI, 10,0 экв) в N,N-диметилформамиде для образования небольшого количества иодистого водорода in situ[18].
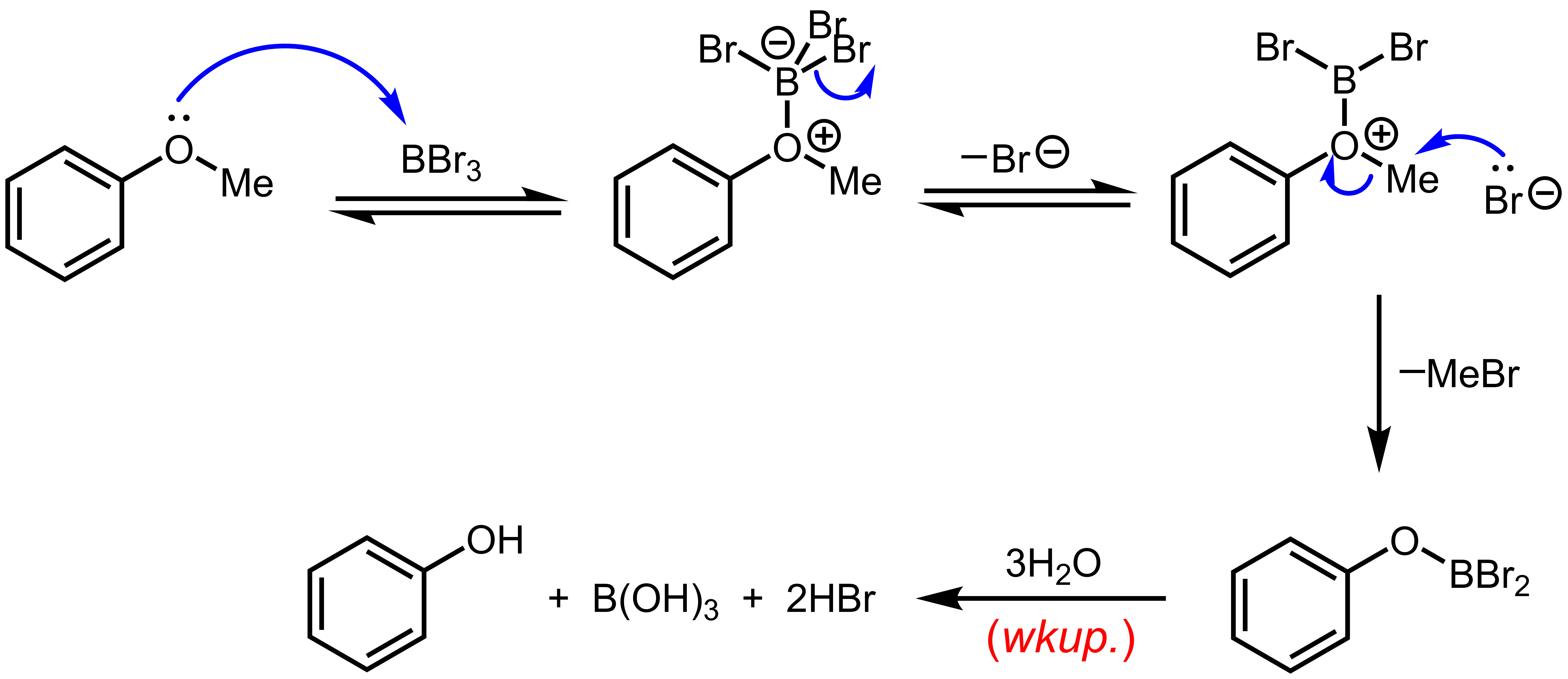
Трибромид бора, который может использоваться при комнатной температуре или ниже, является более специализированным реагентом для деметилирования ароматических метиловых эфиров. Механизм деалкилирования эфира происходит через начальное обратимое образование аддукта кислоты Льюиса с основанием Льюиса между сильно кислотным по Льюису BBr3 и основным по Льюису эфиром. Этот аддукт Льюиса может обратимо диссоциировать с образованием дибромоборилового оксониевого катиона и Br–. Разрыв эфирной связи происходит в результате последующей нуклеофильной атаки на оксониевую частицу Br– с образованием арилоксидибромоборана и бромистого метила. По завершении реакции фенол выделяется вместе с борной кислотой (H3BO3) и бромистоводородной кислотой (водн. HBr) при гидролизе производного дибромоборана во время водной обработки[19].
Более сильные нуклеофилы, такие как диорганофосфиды (LiPPh2), также расщепляют ароматические эфиры, иногда в мягких условиях[20]. Другие сильные нуклеофилы, которые использовались, включают соли тиолатов, такие как EtSNa[21].
Ароматические метиловые эфиры, особенно те, которые имеют соседнюю карбонильную группу, могут быть региоселективно деметилированы с использованием эфирата иодида магния[22]. Примером использования этого является синтез природного продукта кальфостина A[23], как показано ниже.
Метиловые эфиры также подвержены деметилированию, которое обычно достигается путем омыления. Существуют многочисленные высокоспециализированные реакции деметилирования, например, декарбоксилирование Крапчо[en]:
Смесь анетола, КОН и спирта нагревали в автоклаве. Хотя продуктом этой реакции был ожидаемый анол[en], было также обнаружено, что в маточном растворе присутствует высокореактивный продукт димеризации, называемый дианол[en], который был обнаружен Чарльзом Доддсом[en].
N-деметилирование[править]
N-деметилирование третичных аминов происходит по реакции фон Брауна[en], которая использует BrCN в качестве реагента для получения соответствующих нор-производных. Была разработана современная модификация реакции фон Брауна, в которой BrCN заменяется этилхлорформиатом. Получение пароксетина из ареколина является примером применения этой реакции, а также синтез GSK-372,475, например.
N-деметилирование имипрамина дает дезипрамин.
См. также[править]
- Метилирование — присоединение метильной группы к субстрату.
Источники[править]
- ↑ Clayden J., Greeves N. Organic Chemistry. — Oxford, Oxfordshire: Oxford University Press, 2001. — ISBN 978-0-19-850346-0.
- ↑ Advanced Organic Chemistry: Reactions, Mechanisms, and Structure. — 6th. — New York: Wiley-Interscience. — ISBN 978-0-471-72091-1.
- ↑ (2009) «Crystal Structure of Dicamba Monooxygenase: A Rieske Nonheme Oxygenase that Catalyzes Oxidative Demethylation». Journal of Molecular Biology 392 (2): 498–510. DOI:10.1016/j.jmb.2009.07.021. PMID 19616011.
- ↑ (Nov 2010) «Histone demethylases in development and disease». Trends in Cell Biology 20 (11): 662–71. DOI:10.1016/j.tcb.2010.08.011. PMID 20863703.
- ↑ The Ubiquitous Roles of Cytochrome P450 Proteins: Metal Ions in Life Sciences. — New York: Wiley, 2007. — ISBN 978-0-470-01672-5.
- ↑ (October 2013) «TET enzymes, TDG and the dynamics of DNA demethylation». Nature 502 (7472): 472–9. DOI:10.1038/nature12750. PMID 24153300. .
- ↑ (2020) «Formate Metabolism in Health and Disease». Molecular Metabolism 33: 23–37. DOI:10.1016/j.molmet.2019.05.012. PMID 31402327.
- ↑ (2022) «Expanding the repertoire of Rieske oxygenases for O-demethylations». Chem Catalysis 2 (8): 1843–1845. DOI:10.1016/j.checat.2022.07.005.
- ↑ (June 2003) «Lignin biosynthesis». Annu. Rev. Plant Biol. 54 (1): 519–549. DOI:10.1146/annurev.arplant.54.031902.134938. PMID 14503002.
- ↑ Irwin A. Pearl (1949), "«Protocatechulic Acid»", Org. Synth.[en] Т. 29: 85, <http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=CV3P0745>; "«»", Coll. Vol. Т. 3: 745
- ↑ (1962) «Odor and Fallout Control in a Kraft Pulp Mill». Journal of the Air Pollution Control Association 12 (9): 409–436. DOI:10.1080/00022470.1962.10468107. PMID 13904415.
- ↑ (2005) «Recent Advances in Ether Dealkylation». Tetrahedron 61 (33): 7833–7863. DOI:10.1016/j.tet.2005.05.041.
- ↑ (1977) «An improved method for O-demethylation of codeine». Journal of Medicinal Chemistry 20 (1): 165–166. DOI:10.1021/jm00211a037. ISSN 0022-2623. PMID 833817.
- ↑ Hassner Alfred, Stumer C. Organic syntheses based on name reactions. — 2nd. — Amsterdam: Pergamon. — ISBN 9780080513348.
- ↑ 15,0 15,1 Burwell, Robert L. (1954-08-01). «The Cleavage of Ethers». Chemical Reviews 54 (4): 615–685. DOI:10.1021/cr60170a003. ISSN 0009-2665.
- ↑ Vollhardt Peter, Schore Neil Organic chemistry : structure and function. — Seventh. — New York, NY. — ISBN 9781464120275.
- ↑ Streitwieser Andrew, Heathcock Clayton H. Introduction to organic chemistry. — 4th. — Upper Saddle River, N.J.: Prentice Hall. — ISBN 978-0139738500.
- ↑ (June 2008) «An efficient method for demethylation of aryl methyl ethers» (en). Tetrahedron Letters 49 (25): 4054–4056. DOI:10.1016/j.tetlet.2008.04.070.
- ↑ J. F. W. McOmie, D. E. West (1969), "«3,3'-Dihydroxybiphenyl»", Org. Synth.[en] Т. 49: 13, <http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=CV5P0412>; "«»", Coll. Vol. Т. 5: 412
- ↑ Organic Syntheses. — 1977. — Т. 56. — P. 44. — ISBN 978-0471264224.
- ↑ (1973) «Orcinol Monomethyl Ether». Organic Syntheses 53. DOI:10.15227/orgsyn.053.0090.
- ↑ (October 1999) «Regioselective demethylation of 2,6-dimethoxybenzaldehydes with magnesium iodide etherate». Tetrahedron Letters 40 (41): 7363–7365. DOI:10.1016/S0040-4039(99)01411-2.
- ↑ (1 April 2000) «Carbene Complexes in the Synthesis of Complex Natural Products: Total Synthesis of the Calphostins». Journal of the American Chemical Society 122 (13): 3224–3225. DOI:10.1021/ja994313+. PMID 23335811.
Ссылки[править]
 | Одним из источников, использованных при создании данной статьи, является статья из википроекта «Руниверсалис» («Руни», руни.рф) под названием «Деметилирование», расположенная по адресу:
Материал указанной статьи полностью или частично использован в Циклопедии по лицензии CC BY-SA. Всем участникам Руниверсалиса предлагается прочитать «Обращение к участникам Руниверсалиса» основателя Циклопедии и «Почему Циклопедия?». |
|---|