Оксид азота (III)
| Оксид азота (III) | |
| |
| Общие | |
|---|---|
| Систематическое наименование |
Оксид азота(III)
|
| Химическая формула | N2O3 |
| Физические свойства | |
| Состояние | темно-синяя непрозрачная жидкость |
| Молярная масса | 76.01184 г/моль |
| Плотность | 1.4·103 кг м−3, жидкость г/см³ |
| Термические свойства | |
| Т. плав. | −102 |
| Т. кип. | -40 °C |
| Т. разл. | -4 |
| Энтальпия образования | 81 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0,01 г/100 мл |
| Классификация | |
| Рег. номер CAS | [10544-73-7] |
| Безопасность | |
| NFPA 704 | [1] |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Оксид азота (III) (азотистый ангидрид, диазота триоксид, сесквиоксид) — кислотный оксид N2O3, обладающий как восстановительными, так и окислительными свойствами благодаря наличию азота в степени окисления +3. Стабильность этого соединения ограничена низкотемпературными условиями, и при повышении температуры происходит разрушение молекулы. В качестве индивидуального соединения оксид азота (III) существует только в твёрдом состоянии при температуре −101 °C. При более высоких температурах он находится в равновесии с продуктами распада: оксидом азота(II) (NO) и оксидом азота(IV) (NO2)[2][3][4].
Оксид азота (III) — бурый газ, при низких температурах — тёмно-синяя жидкость, в твёрдом состоянии — бесцветное кристаллическое вещество[2][3].
Оксид азота (III) токсичен в больших количествах и является сильным окислителем, вызывающим тяжёлые ожоги кожи[2][3].
Строение вещества[править]
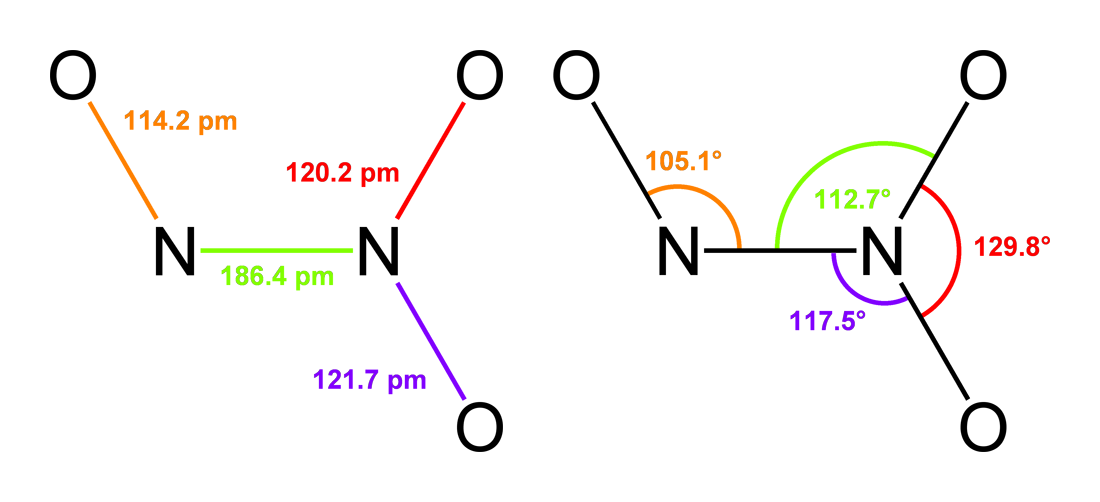
Триоксид диазота (N₂O₃) обладает плоской геометрией. В центре молекулярной структуры располагаются два атома азота, соединённые посредством одинарной ковалентной связи. Один из атомов азота образует σ-связь с одиночным атомом кислорода. Оставшиеся два атома кислорода образуют две π-связи с другим атомом азота, что приводит к образованию триоксида диазота[5].
Плоские молекулы оксида азота (III) образуются посредством донорно-акцепторного механизма N+— O-. В этом процессе один атом выступает в роли донора электронной пары, а другая — в роли акцептора этой пары. В результате такого взаимодействия формируется ковалентная связь между атомами, что приводит к образованию плоской структуры молекулы N2O3[6].
Физические свойства[править]
В газообразном состоянии — бурый газ. При низких температурах оксид азота (III) представляет собой тёмно-синюю непрозрачную жидкость, а в твёрдом состоянии — бесцветное кристаллическое вещество. Температура плавления оксида азота (III) составляет −102 °C, а температура кипения −40 °C. При температуре −4 °C происходит его разложение. Растворимость оксида азота (III) в воде составляет 0,01 г/100 мл, и при взаимодействии с водой он образует азотистую кислоту. В диэтиловом эфире оксид азота (III) хорошо растворим. Плотность жидкости при 2 °C составляет 1,447 г/см3[2][3].
Химические свойства[править]
Разлагается при нагревании[править]
При увеличении температуры достигается состояние равновесия между оксидом азота (III), оксидом азота (II) и оксидом азота (IV). Дальнейшее повышение температуры приводит к смещению равновесия в сторону образования продуктов реакции[3].
Невозможно разобрать выражение (Ошибка преобразования. Сервер («https://wikimedia.org/api/rest_») сообщил: «Cannot get mml. Server problem.»): {\displaystyle {\ce {N2O3 <=>> NO + NO2}}}
Реагирует с водой[править]
Оксид азота(III) представляет собой кислотный оксид, который характеризуется высокой степенью гидратации и способностью к образованию азотистой кислоты при взаимодействии с водной средой[3].
Реагирует с щелочами[править]
Оксид азота(III) является кислотным оксидом и проявляет свойства, характерные для кислотных оксидов при взаимодействии со щелочными реагентами. В результате таких реакций образуются соответствующие соли (нитриты) и вода[7].
Невозможно разобрать выражение (Ошибка преобразования. Сервер («https://wikimedia.org/api/rest_») сообщил: «Cannot get mml. Server problem.»): {\displaystyle {\ce {N2O3 + 2NaOH -> 2NaNO2 + H2O}}}
Реагирует с водным раствором аммиака[править]
Реакция присоединения происходит благодаря образованию связи в ионе аммония посредством донорно-акцепторного механизма[7].
Реагирует с основными оксидами[править]
Оксид азота(III) (азотистый ангидрид, N2O3) проявляет кислотные свойства при взаимодействии с основными оксидами, что приводит к образованию соответствующей соли — нитрита[7].
Невозможно разобрать выражение (Ошибка преобразования. Сервер («https://wikimedia.org/api/rest_») сообщил: «Cannot get mml. Server problem.»): {\displaystyle {\ce {N2O3 + Na2O -> 2NaNO2}}}
Основные свойства[править]
В присутствии концентрированных кислот происходит растворение с образованием катионной формы нитрозония (NO⁺)[3].
Невозможно разобрать выражение (Ошибка преобразования. Сервер («https://wikimedia.org/api/rest_») сообщил: «Cannot get mml. Server problem.»): {\displaystyle {\ce {N2O3 + 2HCIO4 -> 2[NO]CIO4 + H2O}}}
Получение[править]
Реакция азотистоводородной кислоты с оксидом мышьяка (III)[править]
В растворе азотистоводородная кислота проявляет свойства сильного окислителя благодаря наличию центрального атома азота с высокой степенью окисления (+5). Оксид мышьяка (III), напротив, выступает как восстановитель[3].
Конпропорционирование оксида азота (II) и оксида азота (III)[править]
Оксид азота(III) образуется при низких температурах в ходе окислительно-восстановительной реакции между оксидом азота(II) и оксидом азота(IV). В нормальных условиях реакция протекает в обратном направлении[7].
Реакция соединения азота и кислорода.[править]
Данная реакция осуществляется в среде жидкого воздуха посредством прохождения электрического разряда. Оксид азота(III) демонстрирует стабильность при пониженных температурах[7].
Восстановление азотной кислоты оксидом мышьяка (III)[править]
Для проведения реакции предлагается использовать 50%-й водный раствор азотной кислоты для обработки твёрдого оксида мышьяка(III). В ходе реакции, которая протекает при взаимодействии двух молекул азотной кислоты с одной молекулой триоксида мышьяка, образуются газообразные продукты — оксид азота(II) и оксид азота(II), а также мышьяковая кислота. Уравнение данной реакции можно представить следующим образом[3].
После завершения основной стадии реакции, когда смесь продуктов охладится до температуры −36 °C, произойдёт дополнительная химическая реакция между образовавшимися ранее оксидами азота. В результате взаимодействия монооксида азота и диоксида азота образуется оксид азота(III). Эта реакция описывается уравнением[3]:
Реакция тетраоксида диазота с водой[править]
При взаимодействии тетраоксида диазота с водной средой при низких температурах протекает реакция диспропорционирования. В результате данной реакции образуются соответствующие продукты — азотная кислота и оксид азота(III)[8][9].
Реакция тетраоксида диазота и монооксида азота[править]
Азотистый ангидрид (N2O3) синтезируется путем растворения оксида азота (II) в жидком диоксиде азота, который подвергается интенсивному охлаждению. В результате химической реакции между N2O4 и двумя молекулами NO образуется два моль азотистого ангидрида[8][9].
Реакция азотной кислоты с крахмалом[править]
N2O3 может быть получен путём воздействия азотной кислоты (50 %) на крахмал. Образовавшуюся смесь газов осушают с использованием дегидратирующих агентов, таких как, например, безводный сульфат магния или оксид фосфора(V). Затем, попадая в охлаждающую часть химического аппарата, газы вступают в реакцию между собой, превращаясь в синюю жидкость — оксид азота(III)[10]. Реакция предложенная Юстусом фон Либихом[8].
(С6Н10О5)n → 12nHNO3 -> 6nNO + 6nNO2 + 6nCO2 + 11nH2O
Применение[править]
Триоксид азота представляет собой мощный окислитель, обладающий высокой реакционной способностью и находящий применение в различных областях химической промышленности. Одним из ключевых направлений его использования является синтез разнообразных производных азотной кислоты и нитратов. В частности, N2O3 выступает в качестве важного реагента при получении таких соединений, как нитриты и нитраты, которые находят применение в качестве удобрений, взрывчатых веществ и реактивов в аналитической химии. Триоксид азота используется в топливных системах, где он выполняет функцию окислителя, способствуя более эффективному сгоранию топлива и повышению мощности двигателей[10].
В лабораторных условиях триоксид азота участвует в ряде реакций синтеза органических и неорганических соединений, включая производство красителей, полимеров, таких как нейлон, а также фармацевтических препаратов[10].
Уровень опасности и меры предосторожности[править]
Триоксид азота относится к классу опасности 3 согласно классификации ООН, что означает значительную токсичность и необходимость соблюдения строгих мер предосторожности при обращении с ним. Предельно допустимая концентрация (ПДК) триоксида азота в воздухе рабочей зоны составляет 5 мг/м³ (пересчёт на NO2), и превышение этого значения может привести к негативным последствиям для здоровья персонала[11].
Согласно стандарту ГОСТ 31340-07, триоксид азота должен быть помечен символами «Череп и скрещенные кости» (ядовитость), «Пламя над окружностью» (пожароопасность), «Сухое дерево и мёртвая рыба» (экологическая опасность), «Выливающаяся жидкость» (реакция с металлом), а также сигнальными словами «Ядовитый газ» и «Окислитель». Характеристики опасности включают ядовитость, взрывоопасность при нагревании, способность вызывать или усиливать пожар, коррозионное воздействие при взаимодействии с водой и экологическую опасность[11].
При транспортировке триоксида азота необходимо соблюдать следующие требования: номер ООН 2421, надлежащее отгрузочное наименование "Азота триоксид", запрет на перевозку железнодорожным транспортом, классификация опасности по ГОСТ 19433 (класс 2, подклассы 2.2 и 5.1, классификационный шифр 2223), транспортная маркировка (знак опасности по ГОСТ 19433 № 6a, 5, 8) и группа упаковки не применяется.
Для обеспечения безопасной работы с триоксидом азота следует контролировать концентрацию газа в зонах потенциального скопления, использовать средства индивидуальной защиты (специальная одежда, перчатки, защитные очки, респираторы, изолирующий противогаз ИП-4М и огнезащитная экипировка для аварийных ситуаций), и хранить вещество в специально оборудованных помещениях, исключающих контакт с несовместимыми материалами. Срок и условия хранения определяются производителем[11].
Отходы, связанные с использованием триоксида азота, подлежат специальной утилизации в соответствии с действующими нормами и правилами[11].
Экологическое воздействие[править]
Оксид азота(III), известный своей термодинамической нестабильностью, не оказывает существенного непосредственного влияния на экологический статус окружающей среды. Увеличение выбросов оксида азота(III) чаще всего наблюдается исключительно в лабораторных условиях, поскольку N2O3 может существовать в стабильной газовой фазе только при температурах ниже -4°C. В твёрдой фазе оксид азота(III) представляет собой голубоватый порошок. Однако азотистый сесквиоксид, помимо своей токсичности, проявляет мутагенные свойства[12].
Источники[править]
- ↑ Nitric oxide | Cameo Chemicals | NOAA. Архивировано из первоисточника 18 июля 2022. Проверено 1 апреля 2022.
- ↑ 2,0 2,1 2,2 2,3 Азота (III) оксид: физические и химические свойства. Chemport.ru. Проверено 25 декабря 2024.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 3,8 3,9 Кузнецова И. В., Хмелев С. С. Химия азота и его важнейших соединений. Саратовский национальный исследовательский государственный университет имени Н.Г. Чернышевского. Проверено 25 декабря 2024.
- ↑ Ред-кол Химическая энциклопедия В 5 т.: т. 1 / гл. ред. И. Л. Кнунянц. — М: Советская энциклопедия, 1988. — С. 96.
- ↑ Формула триоксида диазота - структура, свойства, применение, примеры вопросов. GeeksforGeeks. Проверено 26 декабря 2024.
- ↑ Оксид азота (III) (N203) и азотистая кислота, оксид азота (IV). Studref.com. Проверено 25 декабря 2024.
- ↑ 7,0 7,1 7,2 7,3 7,4 Оксид азота(III), химические свойства, получение. Acetyl. Проверено 26 декабря 2024.
- ↑ 8,0 8,1 8,2 «Окислы азота».
- ↑ 9,0 9,1 «Азота окислы».
- ↑ 10,0 10,1 10,2 Оксид азота(III). ChemToday — химический портал. Проверено 26 декабря 2024.
- ↑ 11,0 11,1 11,2 11,3 Азота триоксид № ООН 2421 (un2421) - класс опасности, перевозки автоцистернами. Чебоксарское предприятие «Сеспель». Проверено 27 декабря 2024.
- ↑ Очистка от оксидов азота дымовых газов и воздуха, методы улавливания NOX, изготовление и продажа оборудования для азотоочистки — ПЗГО. ПЗГО. Проверено 27 декабря 2024.
 | Одним из источников, использованных при создании данной статьи, является статья из википроекта «Знание.Вики» («znanierussia.ru») под названием «Оксид азота(III)», расположенная по следующим адресам:
Материал указанной статьи полностью или частично использован в Циклопедии по лицензии CC-BY-SA 4.0 и более поздних версий. Всем участникам Знание.Вики предлагается прочитать материал «Почему Циклопедия?». |
|---|








