Адренолейкодистрофия
Адренолейкодистрофи́я (АЛД; боле́знь Зи́мерлинга — Кре́йтцфельда, меланодерми́ческая лейкодистрофи́я) — наследственное заболевание, передающееся по X-сцепленному рецессивному типу. Оно относится к группе пероксисомных болезней и характеризуется преимущественным поражением белого вещества нервной системы и коры надпочечников.Заболевание вызвано дефектами гена ABCD1, расположенного на Xq28, что приводит к недостаточности лигноцероил-КоА-лигазы и, возможно, других ферментов липидного обмена. В результате нарушается процесс β-окисления насыщенных длинноцепочечных жирных кислот (с длиной цепи 24-32 атома углерода) в пероксисомах. Это вызывает накопление этих кислот, а также эфиров холестерина в клетках нервной системы и коркового слоя надпочечников, что и лежит в основе патологических проявлений болезни[1].
История[править]
АЛД изначально описывалась как прогрессирующее заболевание белого вещества головного мозга, связанное с надпочечниковой недостаточностью у мальчиков младше 10 лет, и в 1950-х годах была известна как болезнь Шильдера. Позже появились сообщения о наследственной спастической параплегии, сочетающейся с надпочечниковой недостаточностью у взрослых. В 1970-х годах при электронной микроскопии надпочечников мальчиков, умерших от «болезни Шильдера», были обнаружены внутрицитоплазматические пластинчатые и липидные включения. Вскоре выяснилось, что эти включения состоят из холестерина, фосфолипидов и ганглиозидов, этерифицированных с очень длинноцепочечными жирными кислотами (ОДЦЖК), что стало ключевым диагностическим биомаркером[2].
Биохимической особенностью АЛД является патологическое накопление гексакозановой кислоты. Эти открытия позволили объединить болезнь Шильдера и наследственную спастическую параплегию с надпочечниковой недостаточностью в единый спектр метаболического расстройства, характеризующегося накоплением ОДЦЖК. В конце 1970-х и 1980-х годах клиническая классификация АЛД была уточнена. Группа Хьюго Мозера в Институте Кеннеди Кригера (Балтимор) внесла значительный вклад в изучение заболевания, описав его основные фенотипы.
Ген ABCD1, связанный с развитием АЛД, был идентифицирован в 1993 году методом позиционного клонирования[3].
Классификация[править]
На основании клинических проявлений, возраста дебюта, скорости прогрессирования неврологических симптомов заболевание подразделяют на несколько основных форм[4]:
- церебральные формы (детская; юношеская и взрослая);
- адреномиелонейропатия;
- изолированная надпочечниковая недостаточность;
- Х-сцепленная АЛД у гетерозиготных носительниц.
Этиология[править]
АЛД связана с мутациями в гене ABCD1, расположенном в терминальном участке длинного плеча Х-хромосомы (локус Xq28). Его структура включает 10 экзонов, а общая длина составляет 19 000 пар нуклеотидов. Ген кодирует пероксисомный белок ALDP (Adrenoleukodystrophy Protein), который относится к семейству АТФ-зависимых трансмембранных транспортёров и состоит из 745 аминокислот. Идентифицировано более 2600 мутаций ABCD1, связанных с заменой нуклеотидов ДНК и потерей локусов[3].
Нарушение функции белка ALDP приводит к сбою в транспорте ОДЦЖК в пероксисомы. В норме эти кислоты (поступающие с пищей или синтезируемые в организме) должны расщепляться в пероксисомах. Однако при АЛД их накопление из-за отсутствия деградации становится ключевым звеном в развитии заболевания. Это основной патогенетический механизм, лежащий в основе болезни на молекулярном уровне[3].
Патогенез[править]
Белок ALDP, который относится к семейству АТФ-связывающих кассетных транспортёров (ABC-транспортёров), в норме обеспечивает транспорт насыщенных жирных кислот в пероксисомы, где они должны подвергаться процессу β-окисления. При возникновении генетического дефекта происходит потеря функциональности активности белка, что коренным образом нарушает весь процесс метаболизма жирных кислот в организме[5].
Патогенетическая цепь событий начинается с нарушения транспорта жирных кислот в пероксисомы. Это приводит к двум принципиально важным нарушениям: во-первых, блокируется нормальное β-окисление жирных кислот, во-вторых, запускается процесс патологического удлинения их цепей. В результате образуются ОДЦЖК с длиной углеродной цепи С24-С30 и более, тогда как в норме преобладают жирные кислоты с длиной цепи С16—С20. Эти биохимические изменения становятся отправной точкой для развития патологического процесса[3].
Накопление ОДЦЖК происходит диффузно во всех тканях организма, однако наиболее выраженные патологические изменения наблюдаются в трёх ключевых системах: в нервной системе (с преимущественным поражением белого вещества), в коре надпочечников и в клетках Лейдига, расположенных в яичках. В нервной системе избыток ОДЦЖК запускает каскад последовательных патологических изменений. Во-первых, происходит дестабилизация и последующее разрушение миелиновых оболочек, что связано с изменением физико-химических свойств клеточных мембран. Во-вторых, в клетках формируются характерные ламеллярные цитоплазматические включения. В-третьих, активируется цитокиновый ответ, сопровождающийся массивным привлечением Т-лимфоцитов и макрофагов. В-четвёртых, происходит повреждение гематоэнцефалического барьера. Все эти процессы в конечном итоге приводят к развитию выраженного воспалительного демиелинизирующего процесса, который лежит в основе неврологической симптоматики заболевания[3].
Морфологические изменения при адренолейкодистрофии[править]
Надпочечники: при макроскопическом исследовании поражённые надпочечники выглядят уменьшенными в размерах и атрофичными. Гистологическая картина характеризуется узловой гиперплазией, преимущественно затрагивающей пучковую и сетчатую зоны коры. В клетках обнаруживаются выраженные вакуоли и щелевидные пространства. Мозговое вещество надпочечников обычно остаётся интактным[6].
Патоморфологические изменения ЦНС включают симметричную демиелинизацию белого вещества, с типичным поражением мозолистого тела и затылочно-теменных областей. В тяжёлых случаях в патологический процесс вовлекается и спинной мозг. На клеточном уровне наблюдаются отёк и вакуолизация, вызванные инфильтрацией активированными воспалительными клетками — макрофагами и астроцитами. Эти изменения приводят к прогрессирующей потере миелиновых оболочек, гибели олигодендроцитов и дегенерации аксонов. При гистологическом исследовании в конечной стадии заболевания выявляются участки дистрофической минерализации[6].
Эпидемиология[править]
АЛД преимущественно поражает лиц мужского пола. У мальчиков заболевание проявляется клинически, тогда как у девочек-носительниц мутации обычно протекают бессимптомно. По данным эпидемиологических исследований, распространённость данной патологии составляет примерно 1 случай на 17 тысяч новорождённых мужского пола[7].
Диагностика[править]
Клиническая картина[править]
Х-сцепленная АЛД подразделяется на три основных фенотипа[6]:
- Детская церебральная форма обычно проявляется в возрасте от 3 до 10 лет. Характерным признаком является регресс развития. Заболевание прогрессирует, приводя к тяжёлым неврологическим нарушениям, инвалидизации, коме и летальному исходу. У некоторых взрослых могут развиваться симптомы, аналогичные детской церебральной форме.
- Надпочечниковая недостаточность (болезнь Аддисона) характеризуется дисфункцией надпочечников при Х-сцепленной форме. Снижение выработки альдостерона и кортизола приводит к следующим проявлениям:
- гипонатриемия;
- повышенная утомляемость;
- артериальная гипотензия;
- обезвоживание;
- гипогликемия;
- общая слабость;
- гиперпигментация кожи.
- Адреномиелоневропатия представляет собой более лёгкий вариант течения Х-сцепленной формы. У мужчин заболевание обычно дебютирует в возрасте 20—30 лет, у женщин — в постменопаузальном периоде. Первые симптомы часто связаны с нарушением функции спинного мозга. Около 65 % женщин с этой формой проявляют симптомы заболевания к 65 годам. Большинство мужчин, доживающих до взрослого возраста, имеют именно эту форму адренолейкодистрофии.
Для адреномиелоневропатии характерно хроническое прогрессирующее поражение аксонов в чувствительных и двигательных путях спинного мозга, что приводит к[6]:
- прогрессирующей спастической параплегии;
- периферической нейропатии;
- нарушению функции сфинктеров мочевого пузыря и кишечника;
- сексуальной дисфункции;
- некоторых случаях отмечается надпочечниковая недостаточность. При вовлечении мозжечка развиваются нарушения походки, атаксия и неустойчивость. Отдельно выделяются неонатальную форму, которая может проявляться сразу после рождения, однако у некоторых младенцев отмечаются лишь лёгкие симптомы, что может приводить к задержке диагностики[6].
Для неонатальной формы характерны следующие симптомы[6]:
- судороги, мышечная гипотония и нарушения слуха;
- потеря зрения, катаракта и дисплазия зрительного нерва;
- желтуха и увеличение печени;
- задержка развития и лицевые дизморфии (гипертелоризм, уплощение средней части лица).
Лабораторная диагностика[править]
Биохимический анализ крови: характерно повышение концентрации ОДЦЖК, включая увеличение концентрации докозановой, тетракозановой и гексакозановой кислот, а также характерное изменение их соотношений[3].
Исследование культуры фибробластов: выявляет нарушения метаболизма жирных кислот и пероксисомные нарушения[3].
Молекулярно-генетический анализ: выявляются мутации гена ABCD1 методом секвенирования[3].
Инструментальная диагностика[править]
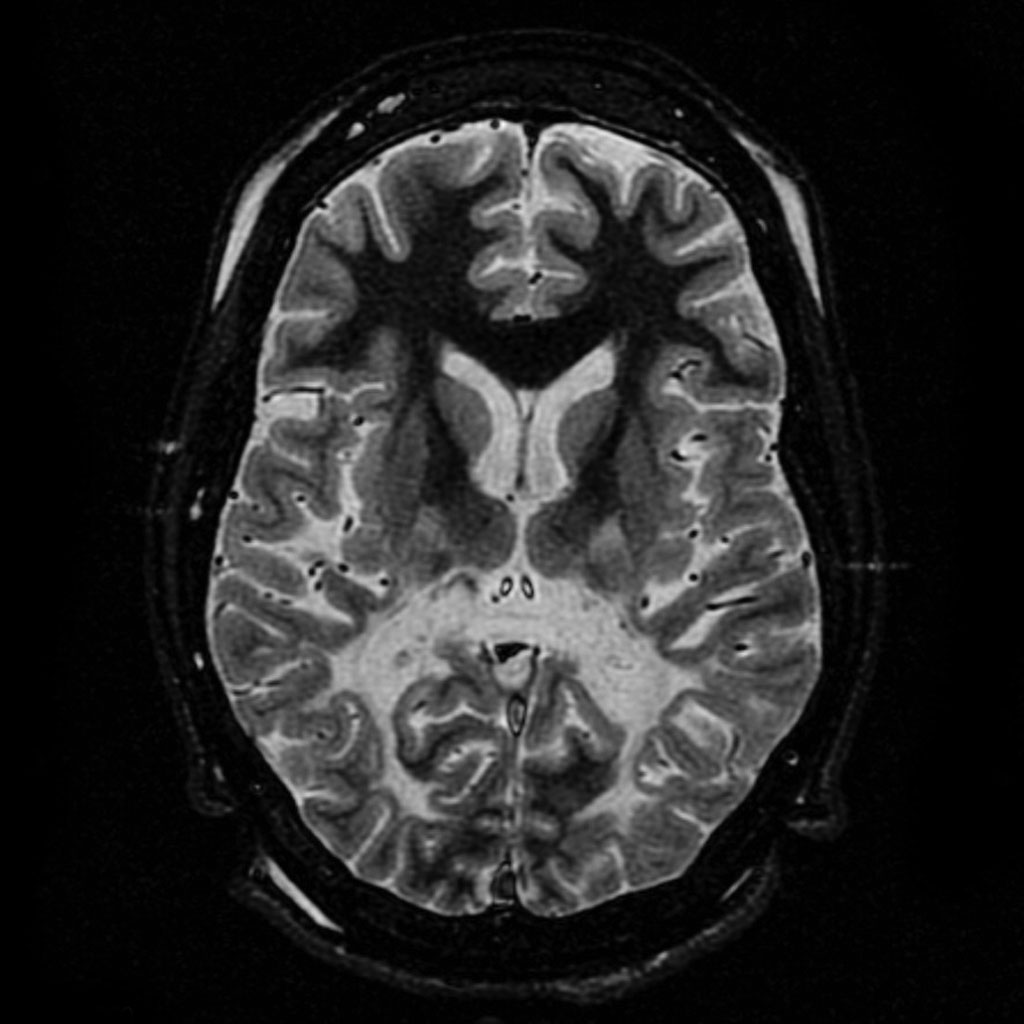
Магнитно-резонансная томография головного мозга: на начальных стадиях заболевания выявляются характерные изменения в белом веществе головного мозга. На томограммах в режиме Т2-взвешенного изображения определяется гиперинтенсивный сигнал в области валика мозолистого тела. На этой стадии контрастное усиление в поражённых участках отсутствует. По мере прогрессирования заболевания наблюдается симметричное поражение затылочных и теменно-затылочных отделов мозга с вовлечением прилежащего субкортикального белого вещества. Развивающийся воспалительный процесс в зонах демиелинизации приводит к нарушению целостности гематоэнцефалического барьера, что проявляется накоплением контрастного вещества при повторных исследованиях[3].
Дифференциальная диагностика[править]
Дифференциальная диагностика АЛД проводится со следующими заболеваниями[5][6]:
- синдром Ангельмана;
- синдром Прадера — Вилли;
- синдром Цельвегера;
- болезнь Рефсума;
- ризомелическая точечная хондродисплазия 1-го типа;
- гипоксически-ишемическая энцефалопатия;
- миотоническая дистрофия;
- острый диссеминированный энцефаломиелит;
- рассеянный склероз;
- ретинопатия с лейкодистрофией;
- дефицит ацил-КоА-оксидазы;
- энцефалопатия из-за дефекта пероксисомного деления;
- лейкоэнцефалопатия с дистонией.
Лечение[править]
Этиотропной терапии АЛД не существует. Одним из ключевых направлений терапии АЛД является диетическое питание с ограничением жиров, направленное на нормализацию уровня ОДЦЖК в плазме крови[3].
При развитии надпочечниковой недостаточности пациентам назначается заместительная гормональная терапия кортикостероидами, требующая регулярного мониторинга гормонального профиля и электролитного баланса[3].
Наиболее перспективным методом лечения АЛД с минимальными или умеренными поражениями ЦНС является трансплантация гемопоэтических стволовых клеток. Клинические наблюдения свидетельствуют о положительной динамике после проведения трансплантации — улучшении когнитивных функций и регрессе патологических изменений, выявляемых при нейровизуализации[3].
Активно разрабатываются инновационные методы генной терапии, которые в перспективе могут стать новым стандартом лечения этого тяжёлого заболевания. Эти подходы направлены на коррекцию генетического дефекта и восстановление нормального метаболизма жирных кислот[3].
Прогноз[править]
Прогноз при неонатальной АЛД и большинстве форм Х-сцепленной АЛД остаётся неблагоприятным. Однако пациенты с адреномиелоневропатией могут доживать до 65 лет и старше, хотя обычно с существенными функциональными нарушениями[6].
Диспансерное наблюдение[править]
Для мальчиков в возрасте от 3 до 12 лет с подтверждённым диагнозом АЛД, но без признаков поражения нервной системы, рекомендуется проведение магнитно-резонансной томографии головного мозга с контрастным усилением каждые 6 месяцев[4].
У пациентов старше 12 лет риск развития церебральной формы АЛД снижается, однако сохраняется вероятность поражения головного мозга. Поэтому магнитно-резонансную томографию с контрастом следует проводить при первых клинических признаках неврологического дефицита[4].
Для пациентов с взрослыми формами АЛД, включая адреномиелонейропатию, рекомендуется следующий алгоритм наблюдения[4]:
- Неврологический осмотр должен проводиться дважды в год с обязательной коррекцией симптоматической терапии, направленной на: купирование спастического синдрома, уменьшение нейропатических болевых ощущений, коррекцию других доминирующих неврологических нарушений.
- Обязательными являются консультации: специалиста по лечебной физкультуре, физиотерапевта, уролога (при развитии дисфункции тазовых органов).
- Нейровизуализационный мониторинг: ежегодное проведение магнитно-резонансной томографии головного мозга (в связи с сохраняющимся риском церебрального вовлечения).
Профилактика[править]
В целях профилактики возможно проведение пренатальной диагностики АЛД с использованием как биохимических (определение уровня ОДЦЖК в плазме крови), так и методов ДНК-анализа. Обследование рекомендовано для родственников по материнской линии[4].
Примечания[править]
- ↑ Чумак С. А., Песочина Э. А., Озерова Л. С., Печерский Б. В. О семейной адренолейкодистрофии рус. // Проблемы Эндокринологии : журнальная статья. — 2001. — Vol. 47. — № 3. — С. 29—33. — DOI:10.14341/probl11527
- ↑ Stephan Kemp, Irene C. Huffnagel, Gabor E. Linthorst, Ronald J. Wanders, Marc Engelen Adrenoleukodystrophy – neuroendocrine pathogenesis and redefinition of natural history англ. // Nature Reviews Endocrinology. — 2016-06-17. — В. 10. — Vol. 12. — С. 606–615. — ISSN 1759-5029. — DOI:10.1038/nrendo.2016.90
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 3,11 3,12 Еремина Е. Р. Х-сцепленная адренолейкодистрофия: некоторые сведения о заболевании // Вестник Бурятского государственного университета. Медицина и фармация. — 2015. — № 12.
- ↑ 4,0 4,1 4,2 4,3 4,4 Новиков П. В., Михайлова С. В., Захарова Е. Ю., Воинова В. Ю. Федеральные клинические рекомендации по диагностике и лечению Х-сцепленной адренолейкодистрофии. Май 2013 г. Министерство Здравоохранения Российский Федерации. 05.2013.
- ↑ 5,0 5,1 Raymond G.V., Moser A.B., Fatemi A. X-Linked Adrenoleukodystrophy. — Seattle (WA): University of Washington, Seattle, 1993—2025. — (GeneReviews® [Internet]).
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 6,6 6,7 Alsaleem M., Haq N., Saadeh L. Adrenoleukodystrophy. — Treasure Island (FL): StatPearls Publishing, 2025. — (StatPearls [Internet]).
- ↑ Гирш Я. В., Якимова К. А. Клинический случай Х-сцепленной адренолейкодистрофии у мальчика 9 лет рус. // Бюллетень сибирской медицины : журнальная статья. — 2022. — Vol. 21. — № 1. — С. 197—202. — DOI:10.20538/1682-0363-2022-1-197-202
Литература[править]
- Ерёмина Елена Робертовна, Назаренко Людмила Павловна Клинический случай Х-сцепленной адренолейкодистрофии // Байкальский медицинский журнал. — 2015. — № 4.
- Волкова Анна Ральфовна, Лискер Анна Владимировна, Остроухова Елена Николаевна, Семикова Галина Владимировна, Дыгун Ольга Дмитриевна, Мозгунова Валентина Сергеевна Адренолейкодистрофия у больного с первичным гипокортицизмом // Эндокринология: Новости. Мнения. Обучение. — 2019. — № 1 (26). — DOI:10.24411/2304-9529-2019-11007
- Н. В. Худякова, И. Ю. Пчелин, А. Н. Шишкин, О. В. Соловьёв, В. В. Смирнов Адренолейкодистрофия/адреномиелонейропатия и гиперактивный мочевой пузырь. Обзор литературы // Juvenis scientia. — 2023. — № 5. — DOI:10.32415/jscientia_2023_9_5_20-30
Одним из источников, использованных при создании данной статьи, является статья из википроекта «Рувики» («ruwiki.ru») под названием «Адренолейкодистрофия», расположенная по адресу:
Материал указанной статьи полностью или частично использован в Циклопедии по лицензии CC-BY-SA 4.0 и более поздних версий. Всем участникам Рувики предлагается прочитать материал «Почему Циклопедия?». |