Эндомиокардит Лёффлера
Эндомиокарди́т Лё́ффлера (ЭЛ)— это редкая рестриктивная кардиомиопатия, вызванная избыточной эозинофильной инфильтрацией эндокарда и миокарда. Повреждение тканей возникает из-за дегрануляции эозинофилов, что провоцирует фиброз и рестриктивные гемодинамические нарушения. Характерный признак заболевания — образование тромбов на поверхности поражённого эндокарда. ЭФ рассматривают как проявление гиперэозинофильного синдрома с преимущественным поражением сердца[1][2].
История[править]
Впервые эозинофильный пристеночный эндокардит описал в 1936 году В. Лёффлер. В последующем это заболевание упоминалось в медицинской литературе под различными названиями: «фибропластический париетальный эндокардит с эозинофилией» и «гиперэозинофильный синдром»[2].
Классификация[править]
По этиологии выделяют следующие типы ЭЛ[2]:
- первичный (миелопролиферативный) тип: связан с заболеваниями кроветворной системы (лейкоз или лимфома);
- вторичный (реактивный) тип: развивается на фоне аллергических, паразитарных заболеваний или злокачественных опухолей, сопровождающихся выраженной эозинофилией;
- идиопатический тип: редкая форма, при которой стойкая гиперэозинофилия возникает без установленной причины.
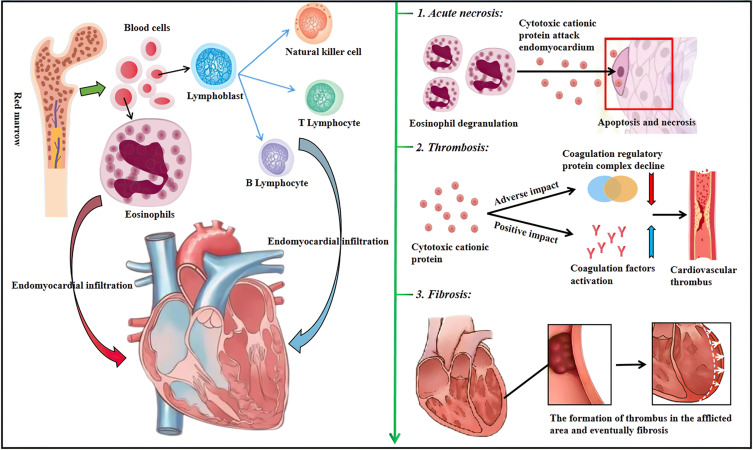
Течение ЭЛ характеризуется 3 стадиями развития. Каждая стадия имеет характерные патоморфологические и клинические особенности[3]:
- острая некротическая стадия (первые 1-2 месяца): характеризуется эозинофильной инфильтрацией миокарда с дегрануляцией и высвобождением токсических белков. На гистологическом уровне выявляются очаги повреждения миокарда и стерильные микроабсцессы. Эта стадия часто протекает бессимптомно, возможны лишь незначительное повышение активности тропонинов и точечные кровоизлияния в конъюнктиву. При эхокардиографии изменения обычно отсутствуют, однако магнитно-резонансная томография сердца может выявить раннее субэндокардиальное накопление контраста;
- тромботическая стадия (около 10 месяцев от начала): развивается вследствие эндотелиального повреждения и активации коагуляции. Фермент эозинофильная пероксидаза способствует образованию гипотиоциановой кислоты, стимулирующей выработку тканевого фактора. Дополнительным механизмом является прямое высвобождение тканевого фактора эозинофилами. Результатом становится формирование пристеночных тромбов, возможны нарушения подвижности клапанов. Пациенты этой группы имеют высокий риск тромбоэмболических осложнений (инсульт, ишемия конечностей);
- фиброзная стадия (через 1-2 года): происходит замещение тромбов фиброзной тканью с вовлечением эндокарда, клапанов и хорд. Формируется рестриктивная кардиомиопатия с клапанной недостаточностью. В клинической картине преобладают симптомы правожелудочковой или левожелудочковой недостаточности. На эхокардиографии выявляется облитерация верхушечных отделов желудочков, а на магнитно-резонансной томографии - распространённое субэндокардиальное накопление контраста. Дополнительно могут выявляться признаки вторичного повреждения миокарда вследствие коронарного васкулита и инфарктов.
Этиология[править]
Первичный тип ЭЛ связан с миелопролиферативными заболеваниями и патологией стволовых клеток (лейкоз и лимфома). Вторичный гиперэозинофильный синдром имеет реактивную природу и возникает на фоне неопухолевых или паранеопластических синдромов, например, аллергические реакции, паразитарные и грибковые инфекции. Идиопатический ЭЛ представляет собой редкое состояние, при котором повышенное число эозинофилов не имеет явной причины[3].
Патогенез[править]
ЭЛ развивается в рамках гиперэозинофильного синдрома, где ключевым механизмом является повреждение клеток, опосредованное эозинофилами. Интерлейкин-5 — специфический цитокин, отвечающий за дифференцировку эозинофилов. Вместе с интерлейкином-3 и гранулоцитарно-макрофагальным колониестимулирующим фактором он регулирует созревание и дифференцировку эозинофилов из миелоидных клеток-предшественников. Избыточная продукция эозинофилов возникает либо из-за гиперпродукции цитокинов, либо вследствие пролиферации клоновых эозинофилов, связанной с дефектами гемопоэтических стволовых клеток или нарушением сигнальных путей, регулирующих их образование. Дисрегуляция процессов созревания и активации эозинофилов приводит к усилению их биологической активности и последующему повреждению тканей. При инфильтрации сердца эозинофилы выделяют белковые гранулы, которые повреждают эндокард и миокард за счёт прямого токсического действия и активации тромбоцитов. Активированные тромбоциты формируют внутриполостные и внутрисосудистые тромбы, усугубляя поражение эндокарда. Дополнительные механизмы включают активацию фактора фон Виллебранда и фактора свёртывания XII, что нарушает целостность эндотелия, усиливает прокоагулянтную активность и стимулирует образование фибрина[3].
При микроскопическом исследовании миокарда выявляются характерные патологические изменения: участки грануляционной ткани с замещением кардиомиоцитов жировой тканью, клетки миокарда содержат гранулы липофусцина и теряют поперечную исчерченность при сохранности ядер. Интерстициальная ткань неравномерно расширена за счёт склеротических изменений и содержит лимфогистиоцитарные инфильтраты. Эндокард резко утолщён и склерозирован, с очаговыми лимфоидными инфильтратами. На границе с миокардом отмечается выраженное расширение интерстиция с лимфогистиоцитарной инфильтрацией. Важный диагностический признак — наличие эозинофилов в эндокарде. При специальной окраске выявляется характерный «панцирный» склероз эндокарда с одновременным склерозированием стенок микрососудов[1].
Эпидемиология[править]
ЭЛ относится к крайне редким заболеваниям с распространённостью около 0,036 случая на 100 тысяч населения. Наиболее часто данная патология регистрируется в регионах с тропическим и субтропическим климатом. Основную группу пациентов составляют мужчины в возрасте от 30 до 50 лет, тогда как у детей и лиц пожилого возраста это заболевание встречается в единичных случаях[1][2].
Диагностика[править]
Клиническая картина[править]
ЭЛ характеризуется разнообразными клиническими проявлениями, которые развиваются поэтапно по мере прогрессирования заболевания. В начальной стадии преобладают неспецифические системные симптомы: немотивированная потеря веса, постоянная слабость и утомляемость, периодическое повышение температуры тела (от субфебрилитета до лихорадки), боли в животе неясного генеза, сухой кашель и кожные высыпания. Сердечные симптомы могут первоначально отсутствовать, однако у 50-60% пациентов уже на ранних этапах появляется одышка - сначала при физической нагрузке, а затем и в покое. По мере развития заболевания формируется типичная клиническая картина рестриктивной кардиомиопатии с признаками нарастающей сердечной недостаточности: ортопноэ (необходимость спать с приподнятым изголовьем), приступы ночного удушья, повышенная утомляемость при минимальной активности. У пациентов может развивается клиника застойной сердечной недостаточности. Характерно поражение клапанного аппарата - чаще всего развивается митральная недостаточность, реже - аортальная недостаточность или стеноз. Это проявляется типичными симптомами клапанных пороков: сердцебиением, болями в прекардиальной области, головокружениями вплоть до синкопальных состояний при нарушениях ритма. В терминальной стадии присоединяются признаки бивентрикулярной недостаточности: асцит, гепатомегалия, периферические отеки, кровохарканье. У некоторых больных могут отмечаться симптомы перикардита. Выраженные метаболические нарушения и прогрессирующая сердечная недостаточность приводят к резкому ухудшению общего состояния, кахексии и полиорганной недостаточности[2][3].
При физикальном обследовании у пациентов выявляются характерные симптомы бивентрикулярной сердечной недостаточности: набухание и пульсация шейных вен, влажные хрипы в лёгких, увеличенная и болезненная печень, периферические отёки. Аускультативно может определяться патологический третий тон сердца. При развитии мерцательной аритмии пульс становится нерегулярным[3].
Инструментальная диагностика[править]
Электрокардиография: могут отмечаться неспецифические изменения, например, депрессия сегмента ST, инверсия зубца Т, признаки гипертрофии левого желудочка и увеличения левого предсердия, отклонение электрической оси влево, неполная блокада правой ножки пучка Гиса. Также могут регистрироваться нарушения ритма - фибрилляция предсердий, предсердные и желудочковые экстрасистолы. Патогномоничных ЭКГ-признаков заболевания не существует[3].
Трансторакальная эхокардиография: является основным методом диагностики. В начальной некротической стадии изменения могут отсутствовать. По мере прогрессирования выявляется утолщение эндокарда и пристеночные тромбы. Наличие тромба в области верхушки желудочка при сохранённой её подвижности должно настораживать в отношении данного диагноза. На ранних стадиях тромбы в верхушке желудочков можно ошибочно принять за апикальный вариант гипертрофической кардиомиопатии, однако слоистая структура с разной степенью эхогенности скорее свидетельствует о тромботических массах. Характерным признаком является "сливающийся" контур желудочков при апикальном сканировании. В фиброзной стадии эндокард становится гиперэхогенным, особенно в области верхушки. Поражение может затрагивать только верхушку, распространяться на клапанный аппарат либо иметь мозаичный характер с участками неизменённого миокарда. В поздних стадиях развиваются типичные признаки рестриктивной кардиомиопатии: диастолическая дисфункция различной степени, дилатация предсердий, уменьшение полости левого желудочка при сохранной фракции выброса. Клапанные нарушения проявляются утолщением и фиброзом атриовентрикулярных клапанов с развитием регургитации. Может отмечаться поражение хорд и ограничение подвижности створок, приводящее к эксцентрической регургитации. У 10-32% пациентов выявляется гидроперикард[3].
Магнитно-резонансная томография: характерная картина включает субэндокардиальное накопление контраста в верхушечных отделах, не соответствующее зонам коронарного кровоснабжения, с распространением на подклапанные структуры. На Т2-взвешенных изображениях чётко виден отёк миокарда в острой стадии, а позднее контрастирование показывает степень фиброзного поражения. Типичный признак - "лентообразное" субэндокардиальное усиление контраста, особенно выраженное в верхушке левого желудочка[3].
Биопсия миокарда с гистологическим исследованием: остаётся "золотым стандартом" диагностики, однако ввиду инвазивности процедуры проводится только в сложных диагностических случаях. Результаты исследования существенно варьируют в зависимости от стадии заболевания[3]:
- Острая (некротическая) стадия:
- выявляется повреждение миокарда, опосредованное эозинофилами;
- обнаруживаются утолщённые и рыхлые коллагеновые волокна.
- Тромботическая стадия:
- визуализируются пристеночные тромбы;
- выраженная эозинофильная инфильтрация.
- Фиброзная стадия:
- массивное разрастание фиброзной ткани;
- утолщение эндокарда.
Трепанобиопсия костного мозга позволяет определить процентное содержание эозинофилов и используется для морфологического анализа и молекулярно-генетических исследований[4].
Лабораторная диагностика[править]
Клинический анализ крови: характерна стойкая гиперэозинофилия (>1.5×10⁹/л) как минимум в двух последовательных анализах крови[3].
Всем пациентам с подозрением на гиперэозинофильный синдром проводится молекулярно-генетическое исследование на наличие мутации FIP1L1-PDGFRA методом флуоресцентной гибридизации[3].
Дифференциальная диагностика[править]
Дифференциальная диагностика ЭЛ проводится со следующими состояниями[4]:
- рестриктивная кардиомиопатия другого генеза (амилоидоз, саркоидоз, гемохроматоз);
- диастолическая дисфункция на фоне гипертонической болезни с поражением сердца;
- синдром Чарга — Стросса (эозинофильный гранулематоз с полиангиитом);
- гигантоклеточный миокардит;
- лекарственная гиперчувствительная реакция с эозинофилией;
- тропический эндомиокардиальный фиброз.
Осложнения[править]
Возможные осложнения ЭФ[3]:
- застойная сердечная недостаточность;
- пристеночный тромбоз верхушки желудочков;
- системная и коронарная эмболия (инсульт, инфаркт миокарда, инфаркт почки,инфаркт селезёнки);
- митральная регургитация;
- аортальная регургитация или стеноз;
- поражение трикуспидального клапана.
Лечение[править]
ЭЛ как кардиальное проявление гиперэозинофильного синдрома требует поэтапного патогенетического лечения. Основные терапевтические направления строятся на принципах подавления эозинофильной инфильтрации, профилактики органных повреждений и коррекции развившихся осложнений[4].
На первом этапе терапии ключевая роль принадлежит кортикостероидам, которые демонстрируют наибольшую эффективность в острый воспалительный период заболевания. При недостаточном ответе на стероидную терапию или при наличии противопоказаний переходят к использованию цитостатических препаратов - гидроксимочевины или азатиоприна. Современным направлением является применение таргетных препаратов: моноклональных антител к интерлейкину-5 (меполизумаб) и ингибиторов тирозинкиназ (иматиниб), особенно у пациентов с выявленной FIP1L1-PDGFRA мутацией[4].
Параллельно с подавлением эозинофилии проводится активная терапия сердечно-сосудистых проявлений. При развитии сердечной недостаточности применяют комплекс препаратов, включающий диуретики для уменьшения застойных явлений, бета-блокаторы для контроля ритма и снижения нагрузки на миокард, ингибиторы ангиотензин-превращающего фермента или блокаторы рецепторов ангиотензина для воздействия на нейрогуморальные механизмы прогрессирования недостаточности, а также антагонисты альдостерона. Обязательным компонентом лечения является антикоагулянтная терапия, направленная на профилактику тромбоэмболических осложнений[4].
В терминальных стадиях заболевания, при формировании выраженного фиброза и грубых клапанных нарушений, рассматривается вопрос о хирургическом лечении. Оптимальными методами в таких случаях становятся эндокардэктомия, протезирование поражённых клапанов или трансплантация сердца, хотя следует учитывать повышенные риски оперативных вмешательств у данной категории пациентов[4].
Прогноз[править]
Благоприятный прогноз тесно ассоциирован с ранним выявлением заболевания. Однако у значительного числа пациентов заболевание диагностируется на поздних стадиях, часто после появления тяжёлых симптомов, связанных с сердечной или полиорганной недостаточностью. Варианты лечения пациентов с фиброзом ограничены, и двухлетняя летальность в этой группе составляет 30–50. Годичная выживаемость при ЭЛ составляет 70–80%, а десятилетняя – 30%[4].
Диспансерное наблюдение[править]
Не разработано.
Профилактика[править]
Не разработана.
Примечания[править]
- ↑ 1,0 1,1 1,2 Коган Е.А., Благова О.В., Алиева И.Н., Комаров Р.Н., Куклева А.Д. Клинико-морфологическое наблюдение эндомиокардита Лёффлера. Архив патологии. 2020;82(3):47‑50.https://doi.org/10.17116/patol20208203147
- ↑ 2,0 2,1 2,2 2,3 2,4 Яшин С.С., Юнусова Ю.Р., Чадаева М.Н. Клиническое наблюдение эндомиокардита Леффлера. Сибирский научный медицинский журнал. 2023;43(6):229–234. doi: 10.18699/SSMJ20230629
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 3,11 Mubarik A, Iqbal AM. Loeffler Endocarditis. [Updated 2024 Jan 7]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK534850/
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 Su S, Liang L, Lü L, Li M, Zhang X, Jin Y, Wei W, Wan Z. In-Depth Review of Loeffler Endocarditis: What Have We Learned? J Inflamm Res. 2024 Mar 28;17:1957-1969. doi: 10.2147/JIR.S458692.
Литература[править]
- Благова О.В., Алиева И.Н., Недоступ А.В., Коган Е.А., Комаров Р.Н., Чернявский С.В., Сеславинская Т.В., Шелуха П.А., Седов В.П., Гагарина Н.В., Мершина Е.А., Синицын В.Е., Фомин В.В. Морфологически верифицированный ANCA-позитивный панкардит Лёффлера: медикаментозное и хирургическое лечение (рус) // Терапевтический архив : журнал. — 2019. — № 4.
- Трубина Е.В., Сургуцкая М.С., Отт А.В. Трудности диагностики эндокардита Лёффлера (рус) // Ультразвуковая и функциональная диагностика : журнал. — 2022. — № 3. — С. 41-48. — DOI:10.24835/1607-0771-2022-3-41-48
Одним из источников, использованных при создании данной статьи, является статья из википроекта «Рувики» («ruwiki.ru») под названием «Эндомиокардит Лёффлера», расположенная по адресу:
Материал указанной статьи полностью или частично использован в Циклопедии по лицензии CC-BY-SA 4.0 и более поздних версий. Всем участникам Рувики предлагается прочитать материал «Почему Циклопедия?». |