Опсины
Опсины — группа рецепторных белков семейства ретинолидов с молекулярной массой 35-55 кДа, связанных с мембраной G-протеинов (G protein-coupled).
(G-белки фотосинтеза и зрительные фотопигменты).
Опсины обнаружены в мембране галобактерий, светочувствительных фоторецепторных клетках беспозвоночных и позвоночных животных (сетчатка), фотосинтезирующих организмах, в светочувствительном пигменте меланофоров кожи земноводных, радужке лягушки и др.
Введение[править]
Опсины выполняют важную роль в восприятии у животных:
- зрительном;
- обонятельном;
- вомероназальном;
- Меланопсин принимает участие в циркадных ритмах, напрмер, у человека.
Пять групп опсинов вовлечены в зрительный процесс, обеспечивая трансформацию сигнала от фотона — к электрохимическому нервному импульсу (первый шаг в процессе зрительной трансдукции). В сетчатке млекопитающих найдены и другие опсины, например меланопсин (пигмент клеток-меланофоров). В форме бактериородопсина опсины обнаружены в бактериях (эволюция опсинов).
- Эволюция опсинов и фототрансдукция
Опсины- универсальные молекулы фоторецепторов всех визуальных систем в животном мире. Они могут изменять свою конформацию от состояния покоя до состояния сигнализации при поглощении света, что активирует белок G, что приводит к сигнальному каскаду, который вызывает физиологические реакции. Этот процесс захвата фотона и превращения его в физиологический ответ известен как фототрансдукция. Недавние методы клонирования выявили богатый и разнообразный характер этих молекул, обнаруженных в организмах от медузы до людей, функционирующих в визуальных и невизуальных системах фототрансдукции и фотоизомеразах. Здесь мы описываем разнообразие этих белков и их роль в фототрансдукции. Затем мы исследуем молекулярные свойства опсинов, анализируя сайт-направленных мутантов, стратегически разработанный филогенетическим сравнением. Этот сайт-направленный подход мутантов заставил нас идентифицировать многие ключевые особенности эволюции молекул фоторецепторов. В частности, мы обсудим эволюцию противоиона, снижение связывания агонистов с рецептором и молекулярные свойства, которые характеризуют оппоненты палочек, отличные от колбочек опсинов. Мы покажем, как достижения в молекулярной биологии и биофизике дали нам представление о том, как эволюция работает на молекулярном уровне.[1]
Меланопсин[править]
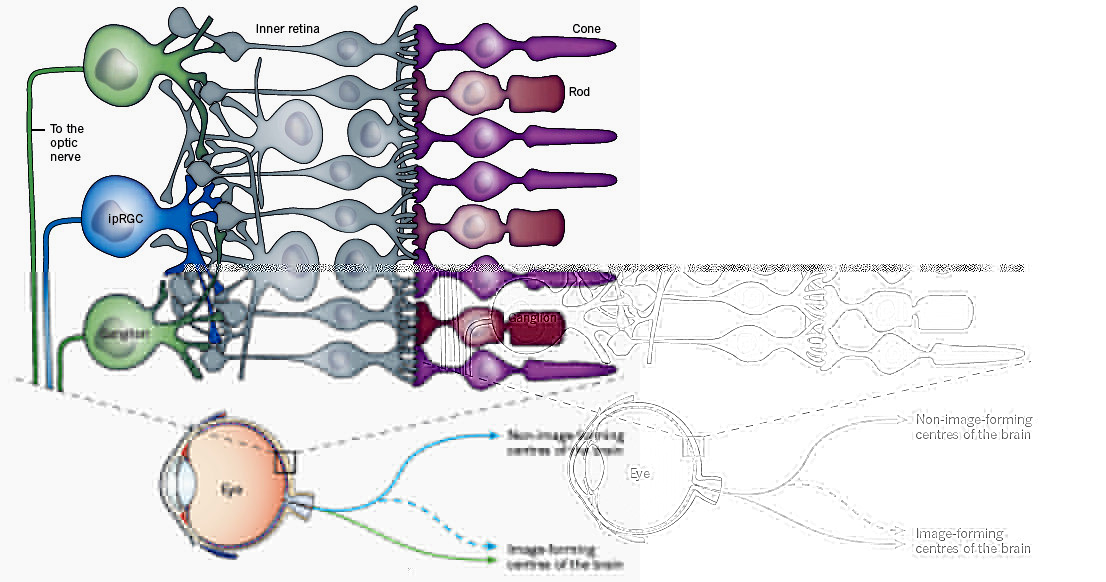
Меланопсин — фотопигмент, один из опсинов, непосредственно участвует в зрительном процессе, в регуляции циркадных ритмов; он находится в специализированных фоточувствительных ганглиальных клетках сетчатки глаза, в коже и мозговых тканях живонтных. Этот зрительный пигмент (фотопигмент) был обнаружен в ганглиальных клетках ipRGC сетчатки глаза млекопитающих.[3]
Мелаопсин принимает участие в режиме «сна-бодрствования», супрессии эпифизального мелатонина у человека; участвует в зрачковом рефлексе, в формировании зрительных образов.
Опсины и фоторецепторы[править]
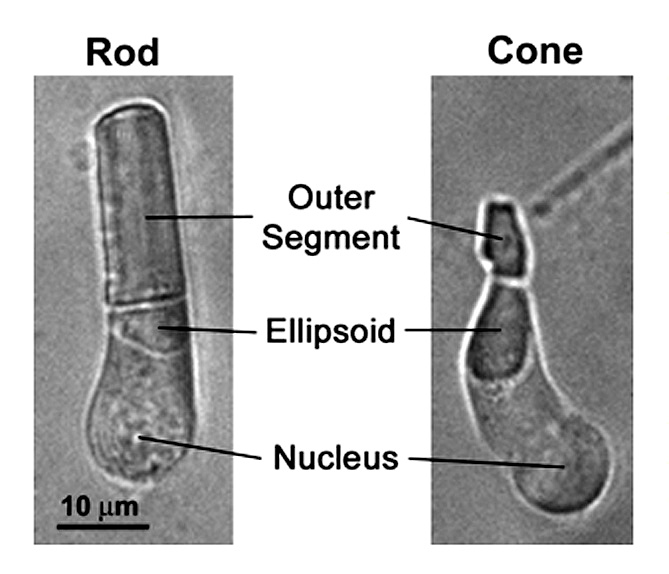
Оптическое изображение формируется в процессе зрения у позвоночных животных и связано с находящимися к сетчатке глаза колбочек (cone) и палочек (rod). Палочки продолжают работать при очень слабых уровнях освещения называемое сумеречным зрением. Они чрезвычайно чувствительны и могут сигнализировать о поглощении одиночных фотонов. Колбочки же намного менее чувствительны к свету, чем палочки. Они участвуют в цветном зрении при достаточно ярком (дневном) свете (иллюстрация 1).
В последние десятилетия получены новые результаты при исследованиях при микроскопии живых клеток с большей разрешающей способностью особенно на флюоресцентных микроскопах, когда полученная трёхмерная цветная информация клеток на молекулярном уровне раскрывает ранее только предполагаемые вопросы цветного зрения, важных процессов фототрансдукции сигналов. С конца 1970-х гг. использовались экспериментальные методы введения электрода в сетчатку, для записи потенциалов (Baylor и др., 1979a). Фоторецепторы земноводных млекопитающих (включая приматов) могут быть исследованы этим методом. Бычья сетчатка раньше была частым объектом в исследованиях из-за изобилия доступной ткани. Позже мышь стала более лучшей моделью для исследования с использованием появившихся генных методов. В сочетании с электрофизиологическими методами, опыты на мышах с определённым геномом дают более точные результаты для объяснения функции ключевых белков фототрансдукции в естественных условиях, что на большом объеме новой информации дали возможность установить ранее предполагаемые принципы, лежащие в основе фототрансдукции сигнала в естественных условиях, увеличения, восстановления и адаптации фотоответов палочка/колбочка (Таблица 1, рис. 2,3).

или мутировали 1) из-за высокого ограничения, но не все генетически проектируемые линии мыши перечислены. Для включенных только перечислены самые существенные фенотипы (в тексте дано более полное описание). 2) Аррестин4 также называют колбочковым аррестином, (X-arrestin) (Gurevich и Gurevich, 2006; Никонов и др., 2008)-->
Аррестин — белок сетчатки, контролирующий светочувствительность родопсина путем связывания с ним; в геноме человека ген, кодирующий аррестин, локализован на участке q24-37 хромосомы 2.
- Опсины и зрительные пигменты

1 — мембранные полудиски;
2 — митохондрия;
3 — ядро (эллипс с жировой каплей);
4 — синаптическая область;
5 — связующий отдел (перетяжка);
6 — наружный сегмент;
7 — внутренний сегмент;
8 — граница мембранной части;
9 — пигмент сократимых фибрилл.
Зри'тельный пигме'нт, структурно-функциональная единица светочувствительной мембраны фоторецепторов сетчатки глаза, найденных в палочках и колбочках (см. рис.1а). Опсин (на базе G-белков) образован в виде связки из семи трансмембранных альфа-спиралей, связанных шестью петлями. В клетках палочек молекулы опсинов (род-опсинов) вложены в мембраны дисков, которые размещаются полностью в клетке. «Голова» N-конечной-остановки молекулы простирается внутрь диска, а «хвост» с C-радикалом простирается в цитоплазме клетки. В клетках колбочки (см. рис.1a) (c кон-опсинами)[6] диски определены плазменной мембраной клетки так, что голова N-конечной-остановки простирается вне клетки. Опсины сетчатки глаза ковалентно связаны с лизином на трансмембранной спирали, самой близкой C-конечной-остановки белка через Шиффовы основания.
В зрительном пигменте осуществляется первый этап зрительного восприятия — поглощение квантов видимого света. Молекула зрительного пигмента (молярная масса около 40 000) состоит из хромофора, поглощающего свет, и опсина — комплекса белков и фосфолипидов. Хромофором всех зрительных пигментов служит альдегид витамина A1 или A2 — ретиналь или 3-дегидроретиналь. Два вида опсина (палочковый и колбочковый) и два вида ретиналя, соединяясь попарно, образуют 4 вида зрительного пигмента, различающихся по спектру поглощения: родопсин (самый распространённый палочковый зрительнsq пигмент), или зрительный пурпур (максимум поглощения 500 нм), иодопсин (562 нм), порфиропсин (522 нм) и цианопсин (620 нм). Первичное фотохимическое звено в механизме зрения состоит в фотоизомеризации ретиналя, который под действием света меняет изогнутую конфигурацию на плоскую. За этой реакцией следует цепь темновых процессов, приводящих к возникновению зрительного рецепторного сигнала, который затем синаптически передаётся следующим нервным элементам сетчатки — биполярным и горизонтальным клеткам.[7]
Классификация опсинов[править]
Oпсины можно классифицировать несколькими способами, включая функцию (видение, фототаксис, фотопериодизм и т. Д.). Тип хромофора (сетчатка, флавин, билин), молекулярная структура (третичная, четвертичная), выход сигнала (фосфорилирование, восстановление, окисление) и т. Д.[8].
Есть две группы белка, называемые опсины.[9][10] Опсины типа I работают на прокариот и с некоторыми водорослями ( в качестве компонента channelrhodopsins ) и грибами,[11]. Когда животные используют тип опсинов II. Никаких опсинов не было обнаружено вне этих групп (например, у растений или плакозоанов ).[12]
В свое время считалось, что тип I и тип II связаны из-за структурного и функционального сходства. С появлением генетического секвенирования стало очевидно, что идентичность последовательности не была больше, чем можно было бы объяснить случайным шансом.
Смотри также[править]
- Фотосинтез
- Оптогенетика
- Палочки (сетчатка)
- Колбочки (сетчатка)
- Труды доктора Р.Е.Марка и его лаборатории
- Основные цвета
- Многокомпонентная теория цветного зрения
Источники[править]
- ↑ http://rstb.royalsocietypublishing.org/content/364/1531/2881
- ↑ http://webvision.med.utah.edu/Melanopsin.html
- ↑ http://c3012152.cdn.cloudfiles.rackspacecloud.com/110119eye.pdf
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://webvision.med.utah.edu/Phototransduction.html#Introduction
- ↑ http://humbio.ru/humbio/ssb/001181d1.htm
- ↑ https://romanbook.ru/book/5078916/?page=3
- ↑ Бьорн, Ларс Олоф (2 января 2015 года). Фотобиология: наука о свете и жизни . Springer. п. 169. ISBN 978-1-4939-1468-5 . Получено 3 сентября 2015 года .
- ↑ Plachetzki, D .; Fong, C .; Oakley, T. (2010). «Эволюция фототрансдукции из предкального циклического нуклеотидного затвора» . Труды: Биологические науки . 277 (1690): 1963-1969 годы. doi : 10.1098 / rspb.2009.1797 . PMC 2880087 Свободно доступный . PMID 20219739.
- ↑ Fernald, RD (2006). «Кастинг генетического света на эволюцию глаз» (PDF) . Наука . 313 (5795): 1914-1918 годы. Bibcode : 2006Sci ... 313.1914F . doi : 10.1126 / наука.1127889 . PMID 17008522.
- ↑ Waschuk, SA; Bezerra, AG; Ши, L .; Браун, Л.С. (28 апреля 2005 г.). «Leptosphaeria rhodopsin: бактериородопсиноподобный протонный насос из эукариот» . Труды Национальной академии наук . 102 (19): 6879-6883. Bibcode : 2005PNAS..102.6879W . doi : 10.1073 / pnas.0409659102 . PMC 1100770 Свободно доступный . PMID 15860584 .
- ↑ Plachetzki, D .; Fong, C .; Oakley, T. (2010). «Эволюция фототрансдукции из предкального циклического нуклеотидного затвора» . Труды: Биологические науки . 277 (1690): 1963-1969 годы. doi : 10.1098 / rspb.2009.1797 . PMC 2880087 Свободно доступный . PMID 20219739 .
Глаз и Зрение. | |||
|---|---|---|---|
| Зрение, Глаз |
Бинокулярное зрение · Стереоскопия · Зрительная система · Зрение человека · Глаз · Анатомия глаза · Бионический глаз · Зрительные отделы головного мозга · Фотопигмент · Опсины · Визуальная фототрансдукция · Визуализация · Перспектива · Микроскопия и фоторецепторы сетчатки · Наружный сетевидный слой сетчатки глаза · Искусственная сетчатка · Ретиномоторная реакция фоторецепторов сетчатки глаза · Аккомодация · Острота зрения человека · Фоточувствительные клетки сетчатки ipRGC · Многокомпонентная теория цветного зрения | ||
| Анатомия глаза |
| ||
| Теории цветовосприятия |
Теории цветового зрения · Религиозная гипотеза зрения · Гипотеза Ломоносова о цветном зрении · Теория цветовосприятия Иоганнеса Мюллера · Теория Юнга - Гельмгольца · Теория Геринга · Психофизическая теория цветоощущения Г. Э. Мюллера · Теория Лэдд-Франклин · Теория Лэнда · Трёхкомпонентная теория · Оппонентная теория · Теория цветовосприятия Джохана Медейроса · Нелинейная теория | ||
| ∘ ∘ См. также: Цветное зрение ∘ ∘ | |||