Дефицит лецитин-холестеролацилтрансферазы
Дефици́т лецити́н-холестеролацилтрансфера́зы (ЛХАТ) — редкое наследственное заболевание, обусловленное частичным или полным отсутствием активности фермента ЛХАТ. Этот фермент, связанный с липопротеинами высокой и низкой плотности, играет ключевую роль в процессе этерификации холестерина — важнейшего этапа метаболизма липопротеинов высокой плотности. Нарушение функции ЛХАТ приводит к сбоям в метаболизме липопротеинов высокой плотности, формированию патологического липидного профиля и развитию характерных осложнений[1].
История[править]
Фермента ЛХАТ был впервые идентифицирован в 1962 году. В 1976 году в медицинской литературе впервые было описано клиническое наблюдение трёх сестёр с дефицитом ЛХАТ[2].
Классификация[править]
Существует две клинические формы дефицита ЛХАТ[1]:
- Семейный дефицит ЛХАТ — полное отсутствие ферментативной активности.
- Болезнь «рыбьего глаза» — частичный дефицит фермента.
Этиология[править]
Дефицит ЛХАТ представляет собой аутосомно-рецессивное заболевание, вызванное мутациями в гене LCAT, расположенном на 16-й хромосоме (локус 16q22). В зависимости от типа мутаций развивается либо полное отсутствие функциональной активности фермента, либо частичное снижение его активности. Эти генетические варианты отличаются степенью нарушения ферментативной функции и соответствующими клиническими проявлениями[1].
Патогенез[править]
Структура и синтез ЛХАТ[править]
→ Лецитинхолестеринацилтрансфераза
ЛХАТ человека представляет собой гликопротеин массой 67 кДа, состоящий из 416 аминокислот. Основной синтез ЛХАТ происходит в печени, меньшие количества вырабатываются в яичках и головном мозге. В плазме крови фермент преимущественно связывается с частицами липопротеинов высокой плотности (ЛПВП), а в меньшей степени — с липопротеинами, содержащими аполипопротеин В (апо-В).
Метаболизм липопротеинов и роль ЛХАТ[править]
Липопротеины представляют собой сферические комплексы, состоящие из липидов, окружённых белками и фосфолипидным монослоем. Метаболизм липидов начинается в желудочно-кишечном тракте, где пищевые триглицериды расщепляются до моноглицеридов, свободных жирных кислот и холестерина, которые затем транспортируются мицеллами жёлчных кислот к кишечным ворсинкам. В энтероцитах эти компоненты вновь синтезируются в триглицериды и упаковываются в хиломикроны. Под действием липопротеинлипазы хиломикроны высвобождают свободные жирные кислоты, а их остатки, богатые холестерином, поступают в печень, где преобразуются в липопротеины очень низкой плотности (ЛПОНП), которые в дальнейшем метаболизируются в липопротеины промежуточной (ЛППП) и низкой плотности (ЛПНП)[1].
Особую роль в липидном обмене играют ЛПВП, которые синтезируются в печени и кишечнике. ЛПВП осуществляют обратный транспорт холестерина из периферических тканей в печень, что является ключевым антиатерогенным механизмом. Этот процесс регулируется ЛХАТ, который катализирует этерификацию свободного холестерина в частицах ЛПВП, способствуя их созреванию и функциональной активности[1].
При дефиците ЛХАТ, когда его активность снижена или полностью отсутствует, в частицах ЛПВП накапливается свободный холестерин. Это нарушает процесс образования эфиров холестерина и приводит к патологическому накоплению липидов — преимущественно неэтерифицированного холестерина и фосфолипидов. Такие изменения липидного состава существенно ухудшают структурную стабильность и функциональную активность ЛПВП, снижая их способность участвовать в обратном транспорте холестерина. В результате нарушается весь процесс липидного обмена, что создаёт предпосылки для развития системных метаболических нарушений[1].
В норме в плазме крови ЛХАТ проявляет два типа активности[2]:
- α-ЛХАТ активность — специфична для α-мигрирующих липопротеинов (ЛПВП);
- β-ЛХАТ активность — действует на β-мигрирующие липопротеины (ЛПОНП и ЛПНП).
Обе формы активности присущи одному и тому же белку. β-форма имеет меньший период полувыведения и быстро выводится почками, тогда как α-форма характеризуется более медленным оборотом[2].
При болезни «рыбьего глаза», которая характеризуется частичным дефицитом фермента ЛХАТ, наблюдается избирательное нарушение активности фермента. В этом случае сохраняется β-ЛХАТ активность (способность этерифицировать холестерин в ЛПОНП и ЛПНП), но полностью утрачивается α-ЛХАТ активность (этерификация холестерина в ЛПВП)[2].
Семейный дефицит ЛХАТ представляет собой более тяжёлую форму заболевания, характеризующуюся полным отсутствием ферментативной активности ЛХАТ. В этом случае у пациентов наблюдается либо полное отсутствие фермента, либо его присутствие в неактивной форме. В отличие от болезни «рыбьего глаза», при семейной форме нарушаются обе функции фермента[2].
Гистологические исследования при дефиците ЛХАТ выявляют характерные патологические изменения в различных органах и тканях. В биоптатах костного мозга, селезёнки и почек обнаруживаются два основных типа патологических клеток: пенистые клетки (ксантомные клетки) и так называемые «морские» синие гистиоциты. Пенистые клетки представляют собой макрофаги, перегруженные неэтерифицированным холестерином и фосфолипидами, что придаёт их цитоплазме характерную пенистую структуру. «Морские» синие гистиоциты отличаются наличием в цитоплазме специфических гранул сине-зелёного цвета, содержащих накопленные липидные соединения[1].
Эпидемиология[править]
Дефицит ЛХАТ является исключительно редким генетическим заболеванием, точные эпидемиологические данные о котором остаются ограниченными. По имеющимся оценкам, распространённость дефицита ЛХАТ составляет приблизительно 1 на миллион человек. В связи с крайне низкой распространённостью не удаётся установить достоверных закономерностей в половом или этническом распределении случаев заболевания[1][3].
Диагностика[править]
Клиническая картина[править]
Клинические проявления дефицита ЛХАТ существенно различаются в зависимости от типа ферментной недостаточности. При полном дефиците фермента (семейная форма заболевания) у пациентов наблюдается комплекс симптомов, включающий[1]:
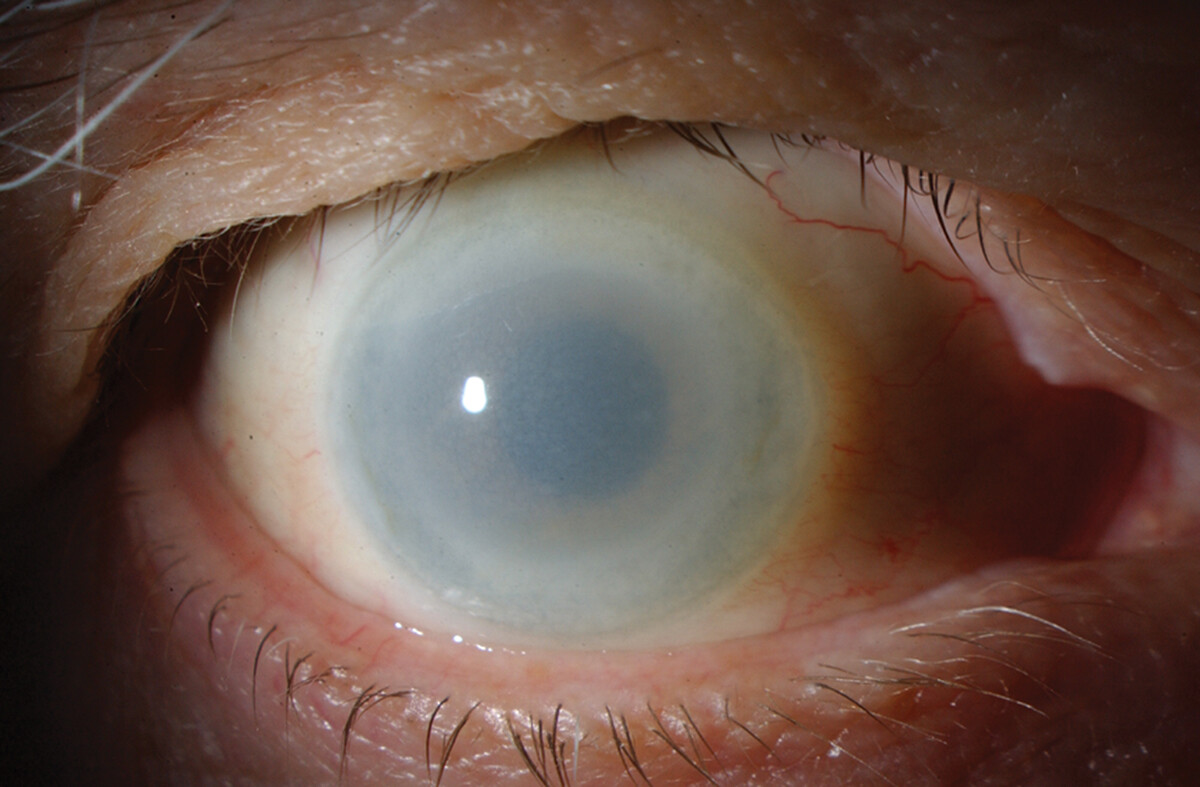
- характерные помутнения роговицы (мелкие сероватые точки, рассеянные в строме, особенно выраженные на периферии);
- почечную недостаточность;
- гемолитическую анемию;
- симптомы атеросклероза (гипертоническая болезнь, нарушение зрения, ишемическая болезнь сердца, ишемия нижних конечностей, острое нарушение мозгового кровообращения);
- ксантелазмы;
- гепатоспленомегалию;
- лимфаденопатию.
При болезни «рыбьего глаза» клиническая картина более скудная. Основным проявлением служат выраженные помутнения роговицы, приводящие к нарушению зрения. Хотя системные симптомы обычно отсутствуют, в некоторых случаях могут наблюдаться умеренное увеличение печени и селезёнки, а также лимфаденопатия. При этой форме заболевания степень помутнения роговицы часто бывает более выраженной, чем при полном дефиците фермента, несмотря на менее тяжёлые системные проявления[1].
Лабораторная диагностика[править]
Клинический анализ крови: при семейном дефиците ЛХАТ выявляется нормохромная нормоцитарная анемия[1].
Биохимический анализ крови[1]:
- при семейной форме: наблюдается повышение активности лактатдегидрогеназы, сочетание прямой и непрямой гипербилирубинемии, а также снижение концентрации гаптоглобина. Липидный профиль демонстрирует выраженные нарушения: концентрация ЛПВП-холестерина резко снижена (обычно менее 10 мг/дл), отмечается повышение уровня ЛПОНП и триглицеридов, значительное увеличение содержания неэтерифицированного холестерина в плазме при одновременном снижении эфиров холестерина;
- при болезни рыбьего глаза: умеренное снижение ЛПВП-холестерина (примерно до 10 % от нормальных значений), повышение ЛПОНП и триглицеридов, увеличение концентрации неэтерифицированного холестерина именно в составе ЛПВП при снижении эфиров холестерина в этой же фракции. При этом показатели ЛПНП и ЛПОНП остаются в пределах нормы.
Клинический анализ мочи: может наблюдаться протеинурия[1].
Инструментальная диагностика[править]
При световой микроскопии материала, полученного при биопсии почки, выявляется умеренное расширение мезангия и утолщение базальной мембраны клубочков, в которой обнаруживаются липидные включения пенистого характера. Аналогичные изменения наблюдаются в стенках интерстициальных кровеносных сосудов. В канальцах почек могут развиваться атрофические процессы. При электронной микроскопии выявляются липидные отложения в базальных мембранах клубочков, внеклеточном матриксе, капсуле Боумена — Шумлянского и сосудистом эндотелии[2].
Дифференциальная диагностика[править]
Дифференциальная диагностика дефицита ЛХАТ проводится со следующими состояниями[1]:
- семейная гиперхолестеринемия;
- болезнь Танжера;
- болезнь Ниманна — Пика;
- гипертриглицеридемия;
- семейный дефицит ЛПВП;
- абеталипопротеинемия.
Осложнения[править]
Осложнения дефицита ЛХАТ зависят от типа ферментативной недостаточности. При полном отсутствии активности фермента у пациентов часто развивается почечная недостаточность, требующей проведения диализа или трансплантации почки[1].
При частичном дефиците ЛХАТ наиболее характерным осложнением является помутнение роговицы, вызванное накоплением холестерина в тканях глаза, что приводит к значительному ухудшению зрения[1].
Выраженная дислипидемия, возникающая при дефиците ЛХАТ, создаёт предпосылки для раннего развития атеросклероза, что существенно повышает риск сердечно-сосудистых заболеваний[1].
Лечение[править]
Специфическая терапия дефицита ЛХАТ не разработана. Пациентам рекомендуется ограничение потребления жиров. Исследования показывают, что низкокалорийная диета с преобладанием овощей может замедлить прогрессирование почечной недостаточности. Описаны случаи, когда комбинация низкожировой диеты с блокаторами рецепторов ангиотензина II приводила к улучшению почечной функции, уменьшению протеинурии и коррекции биохимических нарушений[2].
Эффективность гиполипидемических препаратов при данной патологии остаётся недоказанной. Ведутся разработки новых терапевтических подходов, включая применение рекомбинантной человеческой ЛХАТ для профилактики и лечения почечных осложнений[2].
При трансплантации почки у пациентов с семейным дефицитом ЛХАТ наблюдается временное восстановление почечной функции, однако в большинстве описанных случаев в пересаженном органе впоследствии развиваются характерные гистологические признаки рецидива заболевания[4].
Прогноз[править]
Прогноз при дефиците ЛХАТ зависит от тяжести мутации. Семейная форма дефицита ЛХАТ проявляется более тяжёлой формой заболевания, которое возникает уже в детском возрасте и сопровождается выраженными симптомами. В то же время частичный дефицит ЛХАТ с более мягкими симптомами обычно проявляется позже, во взрослой жизни. Из-за редкости этого состояния в 2025 году имеются ограниченные данные о показателях смертности среди пациентов[1].
Диспансерное наблюдение[править]
Пациентам с дефицитом ЛХАТ требуется постоянное наблюдение у нефролога, офтальмолога, эндокринолога и кардиолога[1].
Профилактика[править]
Не разработана.
Примечания[править]
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 1,15 1,16 1,17 1,18 Carty J.R., Anastasopoulou C. Lecithin-Cholesterol Acyltransferase Deficiency англ. // StatPearls [Internet] : Обзор. — Treasure Island (FL): StatPearls Publishing, 2025.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 Ramesh Saeedi, Min Li, Jiri Frohlich A review on lecithin:cholesterol acyltransferase deficiency // Clinical Biochemistry. — 2015-05. — В. 7—8. — том 48. — С. 472–475. — ISSN 0009-9120. — DOI:10.1016/j.clinbiochem.2014.08.014
- ↑ Roopa Mehta, Daniel Elías-López, Alexandro J. Martagón, Oscar A Pérez-Méndez, Maria Luisa Ordóñez Sánchez, Yayoi Segura, Maria Teresa Tusié, Carlos A. Aguilar-Salinas LCAT deficiency: a systematic review with the clinical and genetic description of Mexican kindred англ. // Lipids in Health and Disease. — 2021-07-13. — В. 1. — том 20. — ISSN 1476-511X. — DOI:10.1186/s12944-021-01498-6
- ↑ Cecilia Vitali, Archna Bajaj, Christina Nguyen, Jill Schnall, Jinbo Chen, Kostas Stylianou, Daniel J. Rader, Marina Cuchel A systematic review of the natural history and biomarkers of primary lecithin:cholesterol acyltransferase deficiency // Journal of Lipid Research. — 2022-03. — В. 3. — том 63. — С. 100169. — ISSN 0022-2275. — DOI:10.1016/j.jlr.2022.100169
Литература[править]
- Перова Н. В., Озерова И. Н., Метельская В. А. Метаболическая система выведения холестерина из тканей. Возможность активации её ключевых звеньев // Рациональная фармакотерапия в кардиологии. — 2006. — № 2.
Шаблон:Нарушения липидного обмена
Одним из источников, использованных при создании данной статьи, является статья из википроекта «Рувики» («ruwiki.ru») под названием «Дефицит лецитин-холестеролацилтрансферазы», расположенная по адресу:
Материал указанной статьи полностью или частично использован в Циклопедии по лицензии CC-BY-SA 4.0 и более поздних версий. Всем участникам Рувики предлагается прочитать материал «Почему Циклопедия?». |