Метан
| Метан | |
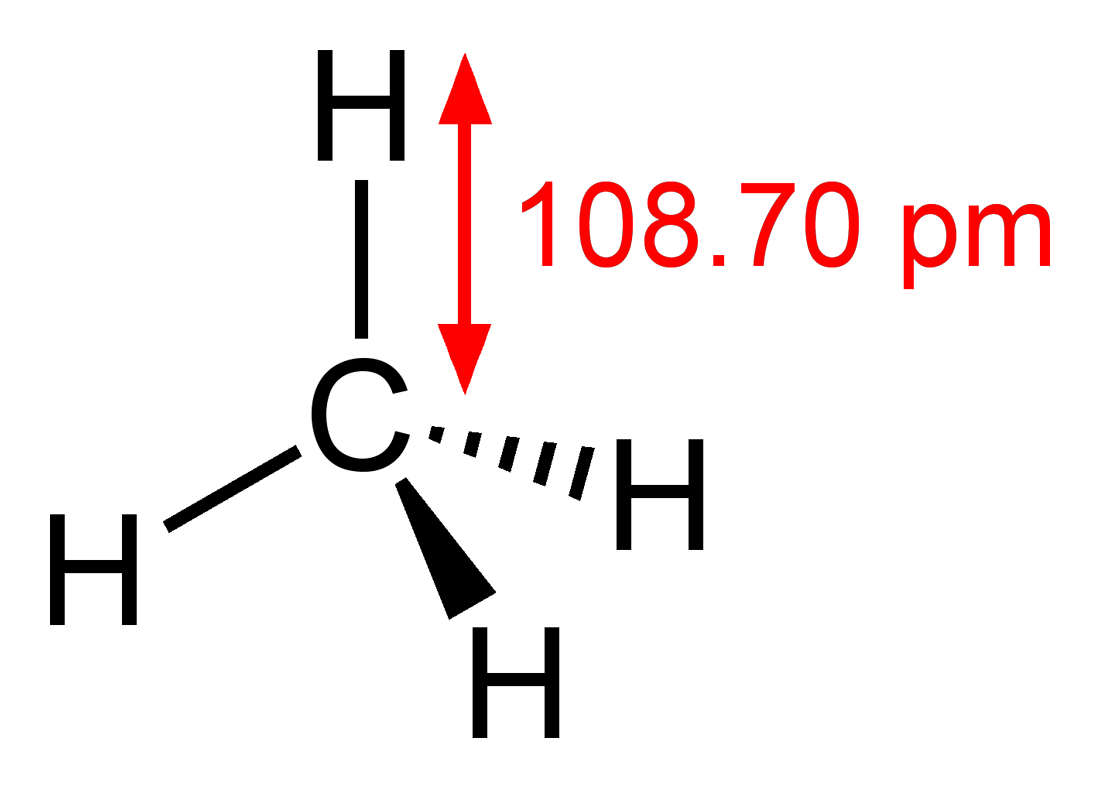
| |

| |
| Общие | |
|---|---|
| Рац. формула | CH4 |
| Физические свойства | |
| Молярная масса | 16,04 г/моль |
| Плотность | газ (0 °C) 0,7168 кг/м³; жидкость (−164,6 °C) 415 кг/м³[1] |
| Термические свойства | |
| Т. плав. | −182,49 |
| Т. кип. | −161,58 °C |
| Т. свспл. | 537,8 °C |
| Пр. взрв. | 4,4−17,0 % |
| Химические свойства | |
| Растворимость в воде | 0,02 г/кг[2] г/100 мл |
| Классификация | |
| Рег. номер CAS | 74-82-8 |
| SMILES | C |
| Безопасность | |
| Токсичность | 
|
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Метан — простейший предельный углеводород, имеющий химическую формулу CH4.
Физические свойства[править]
Метан — бесцветный газ без запаха и вкуса, почти в два раза легче воздуха, растворимый в воде.
Имеет плотность по воздуху 0,555 (при температуре 20 ° C); молекулярная масса 16,04, tпл = −182,49 °C, tкип = −161,56 °C, критическое давление 4,58 МПа, критическая температура −82 ° С, температура вспышки 87,8 °C, температура самовоспламенения 537,8 °C.
Химические свойства[править]
Первый член гомологического ряда насыщенных (метановых) углеводородов. Метан представляет собой малоактивное в химическом отношении вещество. При обычных условиях он достаточно устойчив к воздействию кислот, щелочей и окислителей. Так, при пропускании метана через раствор KMnO4, который является достаточно сильным окислителем, он не окисляется, и фиолетовая окраска раствора не исчезает. В реакции присоединения (ассоциации) метан не вступает, поскольку в его молекуле все четыре валентности атома углерода полностью насыщены. Для метана, как и других насыщенных углеводородов, типичны реакции замещения, при которых атомы водорода замещаются атомами других элементов или атомными группами. Характерна для метана также реакция с хлором, которая происходит при обычной температуре под влиянием рассеянного света (при прямом солнечном свете может произойти взрыв). При этом атомы водорода в молекуле метана последовательно замещаются атомами хлора:
- CH4 + Cl2 = CH3Cl + HCl
- CH3Cl + Cl2 = CH2Cl2 + HCl
- CH2Cl2 + Cl2 = CHCl3 + HCl
- CHCl3 + Cl2 = CCl4 + HCl
Вследствие реакции образуется смесь хлорпроизводных метана.
В атмосфере воздуха метан горит бесцветным пламенем с выделением значительного количества тепла:
- CH4 + 2O2 = СО2 + 2Н2О
С воздухом метан образует огнеопасную взрывную смесь. При нагревании метана без доступа воздуха до температуры выше 1000 ° C он разлагается на элементы — на углерод (сажу) и водород:
- CH4 = С + 2Н2
Распространение в природе[править]
Метан является основным компонентом:
- природных горючих газов (до 99,5 %),
- попутных нефтяных газов (39−91 %),
- болотных (99 %) и рудничных (34−48 %) газов;
- присутствует в газах грязевых вулканов (более 95 %),
- спорадически встречается в вулканических газах и в газах магматических и метаморфических пород.
Большое количество метана растворено в водах океанов, морей, озер. Среднее содержание метана в водах Мирового океана составляет около 10−2 см3 / л, общее количество — 14 · 1012 м3. Количество метана, растворенного в пластовых водах, на несколько порядков выше его промышленных запасов.
Метан присутствует также в атмосферах Земли, Юпитера, Сатурна, Урана; в газах поверхностного грунта Луны. Основная масса метана лито- и гидросферы Земли образовалась при биохимической и термокаталитической деструкции рассеянного органического вещества, угля и нефтей. Метан образуется при анаэробном разложении органических веществ, в частности целлюлозы (метановое брожение).
В природе Земли метан достаточно распространен. Горючие природные газы состоят на 90−97 % из метана. Он образует ряд месторождений, из которых добывается и по газопроводам подается к месту использования. На дне болот и прудов метан образуется в результате разложения остатков растений без доступа воздуха. Поэтому его называют еще болотным газом. Под названием «рудничный газ» метан накапливается в угольных шахтах, в результате выделения из пластов угля и сопутствующих пород, в которых находится в свободном и связанном виде. На действующих шахтах наблюдается выделение метана из угольных пластов в объеме до 70−80 м3/т с. б. м. (т с. б. м. — тонна сухой беззольной массы), что делает экономически целесообразным его самостоятельное или сопутствующее (дегазация) извлечения из угольных месторождений.
Рудничный газ очень опасен, так как с воздухом может образовывать взрывчатую смесь. Наиболее взрывоопасные концентрации метана в воздухе — 9−14 %.
Основной компонент природных (77−99 %), попутных нефтяных (31−90 %), рудничного и болотного газов.
При низких температурах метан образует соединения включения — газовые гидраты, широко распространенные в природе.
Газовые гидраты — твердые кристаллические вещества плотностью 880−890 кг/м3, похожие на снег или лед. Гидратообразования происходят в пористой среде осадочного чехла с формированием газогидратных залежей.
Получение[править]
В лабораториях метан можно получить при нагревании ацетата натрия с твердым гидроксидом натрия или при воздействии воды на карбид алюминия:
- CH3COONa + NaOH = Na2CO3 + CH4↑
- Al4C3 + 12H2O = 4Al(OH)3 + 3CH4↑
Применение[править]
Большие количества метана используются как удобное и дешевое топливо. Неполное сжигание метана дает сажу, которая идет на изготовление печатной краски и как наполнитель каучука, а при термическом разложении (выше 1000 °C) получают сажу и водород, используемый для синтеза аммиака. Продукт полного хлорирования метана — четырёххлористый углерод CCl4 — является хорошим растворителем жиров и применяется для извлечения жиров из зерен масличных растений. Метан служит также исходным веществом для получения ацетилена, метилового спирта и многих других химических продуктов.
Метан как рудничный газ[править]
С воздухом метан образует взрывчатые смеси. При содержании в воздухе до 5−6 % метан горит около источника тепла (температура воспламенения 650−750 ° С), при содержании 5−16 % — взрывается, свыше 16 % — может гореть при притоке кислорода, снижение при этом концентрации метана взрывоопасное.
Метан имеет слабое наркотическое действие. ПДК 300 мг/м3. Выделение метана в выработках шахт создает особую опасность при добыче угля. Различают три формы выделения метана в горных выработках: обычное, суфлярное и внезапное. По метанообильности, согласно «Правилам безопасности в угольных шахтах», шахты делятся на 5 категорий. Критерием такого деления является относительная метанообильность, то есть количество метана в кубометрах, выделяемой за сутки на 1 т среднесуточной добычи:
- до 5 м3/т;
- 5−10 м3/т;
- 10−15 м3/т;
- сверхкатегорийные — более 15 м3/т.
Шахты, разрабатывающие пласты, опасные или угрожающие по внезапным выбросам угля, газа и породы, принадлежат к особой категории — опасных по внезапным выбросам.
Перспективным считается добыча метана из угольных пластов. В конце XX века этой проблемой только в США занимались ученые из 40 университетов, задействовано около 100 фирм. В промышленности метан применяют для получения синтез-газа, ацетилена, хлороформа, четыреххлористого углерода, технического углерода и др. Продукты неполного окисления метана являются исходными для изготовления пластмасс, используемых в органическом синтезе.
Источники[править]
- ↑ Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- ↑ Обзор: Растворимость некоторых газов в воде
Литература[править]
- Деркач Ф. А. «Химия» Л. 1968
- Малая горная энциклопедия. В 3-х т. / Под ред. В. С. Белецкого. — Донецк: Донбасс, 2004. — ISBN 966-7804-14-3.
↑ | |
|---|---|
| Алканы |
Метан • Этан • Пропан • Бутан • Пентан (Изопентан) (Неопентан) • Гексан • Гептан • Октан • Нонан • Декан • Ундекан • Додекан • Тридекан • Тетрадекан • Пентадекан • Гексадекан • Гептадекан • Октадекан • Нонадекан • Пристан • Эйкозан • Генэйкозан • Докозан • Тетракозан • Гентриаконтан • Гектан |
| Алкены |
Этилен • Пропен • Бутены • Пентены • Гексены • Гептены • Октен |
| Алкины | |
| Диены | |
| Другие ненасыщенные | |
| Циклоалканы |
Циклопропан • Циклобутан • Циклопентан • Циклогексан • Циклогептан • Циклооктан • Циклононан • Циклодекан • Циклоундекан • Циклододекан • Циклотридекан • Циклотетрадекан • Циклопентадекан |
| Ароматические |
Бензол • Толуол • Диметилбензолы • Этилбензол • Пропилбензол • Кумол • Стирол • Фенилацетилен • Дифенил • Дифенилметан • Трифенилметан • Тетрафенилметан |
| Полициклические | |
| Полициклические ароматические |
Нафталин • Антрацен • Бензантрацен • Пентацен • Фенантрен • Пирен • Бензпирен • Азулен • Хризен • Инден • Индан |
Бинарные соединения водорода ↑ | |
|---|---|
| Гидриды щелочных металлов | |
| Гидриды щелочноземельных металлов | |
| Гидриды подгруппы бора | |
| Гидриды подгруппы углерода | |
| Пниктогеноводороды | |
| Халькогеноводороды | |
| Галогеноводороды | |
| Гидриды переходных металлов | |
|
см. также: | |
