Лиганд (биохимия)
Лиганд (от лат. Ligo — привязываю), в биохимии и фармакологии — химическое соединение (часто малая молекула), которое образует комплекс (в химии) с той или иной биомолекулой (чаще белком, например, клеточным рецептором, но иногда, например, с ДНК) и производит, в результате такого связывания, те или иные биохимические, физиологические или фармакологические эффекты.
Общая информация[править]
В случае связывания лиганда с белком, лиганд обычно является малой сигнальной молекулой, связывающейся со специфическим участком связывания на белке-мишени (например, на рецепторе). В случае связывания лиганда с ДНК, лиганд как правило также является малой молекулой или ионом,[1] или белком[2] который связывается с двойной спиралью ДНК.
Связывание лиганда с рецептором обычно происходит при помощи сил межмолекулярного взаимодействия, таких, как ионные связи, водородные связи, силы Ван дер Ваальса. Связывание или ассоциация лиганда с рецептором (так называемый «докинг» лиганда в специфическую «нишу» в рецепторе) обычно обратима и кратковременна. Обратный процесс называется диссоциацией лиганда из связи с рецептором. Необратимое ковалентное связывание лиганда с рецептором или другой молекулярной мишенью для данного лиганда является редким состоянидем в биологических системах, в крайнем случае, в физиологических условиях. Тем не менее искусственные, экзогенные лиганды, необратимо ковалентно связывающиеся с молекулами-мишенями. Они существуют, и даже имеют важное значение в медицине, как, например, необратимо алкилирующие ДНК противоопухолевые препараты алкилирующего типа или необратимо инактивирующие МАО (тормозящие) антидепрессанты (психотворные лекарства) группы ИМАО, или необратимо инактивирующий α-адренорецепторы феноксибензамин. В отличие от принятого определения лиганда в металлоорганической и неорганической химии, для процесса взаимодействия лиганда с биомолекулами-мишенями совершенно неважно (и не требуется), чтобы лиганд взаимодействовал именно с металлом-кофактором в составе биологической молекулы (тем более что не все биологические молекулы содержат металлы в качестве кофакторов). Связывание лиганда именно с металлосодержащим положением биологической молекулы, тем не менее, в биологических системах часто встречается и имеет важное биологическое значение как для транспортных белков, таких, как гемоглобин (транспортирующий кислород, углекислый газ. Он способн транспортировать также другие эндогенные газы, в частности эндогенный угарный газ, эндогенный сероводород и эндогенный оксид серы (IV)). А для каталитических ферментов, многие из которых являются металлоферментами (содержат в составе активного каталитического центра ион того или иного металла в управленческом комплексе с белком).
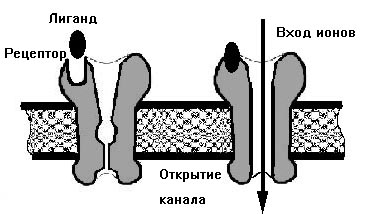
Связывание лиганда с рецептором (рецепторным белком) изменяет его конформационное состояние (трёхмерную пространственную конфигурацию). А это, в свою очередь, может приводить к изменению функционального состояния белка (например, к активации или инактивации рецептора или фермента, к диссоциации одной из субъединиц составного белка или, наоборот, к обретению белком в результате связывания с лигандом способности присоединять другой специфический лиганд или другой белок, или к открытию сопряжённого с белком ионного канала (см. рис.4). А также: к само-фосфорилированию, иной самомодификации белка, появлению возможностей для его фосфорилирования или иной модификации другим белком, и т. д.). В понятие «лиганда» включаются и субстраты ферментов, и распознаваемые антителами антигены, и разнообразные агонисты, антагонисты и обратные агонисты, в том числе эндогенные, такие, как нейромедиаторы, гормоны, цитокины и хемокины. Ингибиторы и активаторы тех или иных ферментов или регуляторных белков, а таеже факторы транскрипции, и экзогенные, такие, как лекарства и т. д. Сила связывания лиганда с белком-мишенью (например, рецептором) называется «сродством», или аффинностью, лиганда к белку-мишени (например, рецептору). Сила связывания лиганда с белком-мишенью определяется не только силой прямых взаимодействий лиганда с данным белком (например, рецептором), но и микроокружением белковой молекулы, в частности, присутствующими вокруг молекулами растворителя, которые могут играть доминантную роль в обеспечении адекватных межмолекулярных взаимодействий нековалентного характера между лигандом и белком-мишенью (вода[3], липиды клеточной мембраны) и белков-партнёров (в случае, например, олигомерных рецепторов или G-белок-связанных рецепторов). В частности, повышение сродства трансмембранных рецепторов к эндогенным агонистам в присутствии холестерина и сфинголипидов является причиной того, что эти рецепторы, как правило, размещаются в определённых местах клеточной мембраны, называемых липидными рафтами, обогащённых холестерином и сфинголипидами.
Радиолигандами называют меченые радиоактивной меткой (тем или иным радиоактивным изотопом) достаточно высокоаффинные и селективные по отношению к некоторому желаемому подтипу рецепторов соединения. Они используются как in vivo для позитронно-эмиссионной томографии (ПЭТ) с целью изучения распределения этих рецепторов в живом организме и степени связывания с этими рецепторами тех или иных лекарств в клинически применяемых дозах, так и in vitro в качестве «горячих лигандов» для определения аффинности (степени сродства к рецептору) «холодного лиганда».
Сродство к рецепторам (аффинность) и молярная активность («потентность») лиганда[править]
Степень сродства лиганда к рецепторам, или так называемая «аффинность» лиганда к рецепторам само по себе ещё не определяет молярную активность (общую «потентность») того или иного лиганда. Молярная активность (потентность) вещества есть результат сложного взаимодействия между его степенью сродства к рецепторам и его внутренней агонистической активностью (или его рецепторной эффективностью). Внутренняя агонистическая активность (рецепторная эффективность) — это количественная характеристика способности данного лиганда вызывать тот или иной биологический ответ после связывания с рецептором, и мера величины вызываемого им биологического ответа, в процентах от максимально возможного биологического ответа, за который принимается максимальная стимуляция эндогенным агонистом (100 %). В зависимости от природы, характера, знака и величины по модулю вызываемого лигандом биологического ответа, он классифицируется либо как агонист или даже суперагонист, либо как частичный агонист, либо как нейтральный антагонист, либо как обратный агонист.[4]
Селективные и неселективные лиганды[править]
Селективные лиганды имеют тенденцию в клинически/физиологически релевантных (как наномолярных) концентрациях клинически/физиологически значимо связываться только с достаточно ограниченным набором подтипов рецепторов (не обязательно, что все эти подтипы будут рецепторами к одному и тому же эндогенному лиганду). В то же время неселективные лиганды имеют тенденцию в релевантных концентрациях значимо связываться с достаточно широким набором подтипов рецепторов (часто — к разным эндогенным лигандам) и, тем самым, производить более широкий спектр клинических, биохимических и физиологических эффектов, как желательных, так и, нередко, нежелательных побочных эффектов.
Селективность лиганда является понятием весьма условным и относительным, поскольку существует очень мало истинно селективных лигандов, которые связываются только с одним подтипом рецепторов во всём диапазоне «разумных», клинически достижимых у человека концентраций, и ещё меньше лигандов, способных сохранять 100 % селективность в тех концентрациях, которые можно создать в экспериментах на животных и тем более «в пробирке» (in vitro). Часто кажущаяся относительная селективность того или иного лиганда теряется при повышении дозы или концентрации (то есть в более высоких концентрациях или дозах он начинает взаимодействовать и с другими подтипами рецепторов), и это имеет важное клиническое значение (так, высокие дозы селективного агониста опиоидных рецепторов бупренорфина способны значимо угнетать дыхание и вызывать эйфорию, так как селективность по сравнению с морфином утрачивается; аналогичным образом высокие дозы селективных β-адреноблокаторов способны вызывать бронхоспазм, так как утрачивается селективность к подтипу β1, а высокие дозы β2-адреностимуляторов помимо устранения бронхоспазма способны также вызывать тахикардию; высокие дозы атипичных антипсихотиков наподобие рисперидона и оланзапина способны вызывать экстрапирамидные побочные явления, подобно типичным антипсихотикам).
Разработка новых, более селективных, лигандов является важной задачей современной экспериментальной и клинической фармакологии: селективные лиганды, избирательно активируя или блокируя только один «нужный» подтип рецепторов или несколько их подтипов, имеют тенденцию проявлять меньше побочных эффектов, в то время как неселективные лиганды, связываясь с широким кругом рецепторов, производят как желательные, так и нежелательные побочные эффекты. Хорошим примером является сравнение относительно неселективного хлорпромазина с более селективным галоперидолом: хлорпромазин, за счёт своей низкой селективности, производит множество побочных эффектов в дополнение к полезному антипсихотическому эффекту (так, α1-адреноблокада приводит к гипотензии и тахикардии, H1-гистаминовая блокада к сонливости, седации, повышению аппетита и прибавке массы тела, М-холиноблокада — к сухости рта и запорам и т. п., в то время как галоперидол эти явления вызывает в значительно меньшей мере и в клинически применяемых дозах вызывает в основном экстрапирамидные побочные явления, непосредственно связанные с его основным D2-блокирующим действием).
Мерой относительной селективности того или иного лиганда является величина соотношения его сродства (аффинности) к «желаемому», «основному» подтипу рецепторов (например, к D2, в случае антипсихотиков), и к ближайшему следующему по порядку величины показателя сродства (аффинности) подтипу рецепторов — то есть значение соотношения Ki(1) / Ki(2). Более высокоаффинные к «желаемому» типу рецепторов, более высокоактивные («более высокопотентные») соединения часто, хотя и не всегда, являются также и более селективными, по крайней мере в малых концентрациях (применение которых, опять-таки, становится возможным именно благодаря более высокой аффинности соединения по отношению к рецептору и большей активности соединения). Таким образом, важной задачей экспериментальной и клинической фармакологии является разработка новых, более высокоаффинных (обладающих более высоким сродством к рецептору) и более активных («более высокопотентных») по отношению к тем или иным типам рецепторов, соединений.
Бивалентные лиганды[править]
Бивалентные лиганды состоят из двух соединённых молекул, каждая из которых является лигандом для определённого подтипа рецепторов (одного и того же или разных), причём в силу особенностей пространственного строения обе части молекулы способны одновременно связываться с двумя частями «составного» гомо- или гетеродимерного рецепторного комплекса. Бивалентные лиганды используются в научных исследованиях с целью обнаружения и исследования рецепторных гомо- и гетеродимерных комплексов и изучения их свойств. Бивалентные лиганды обычно являются крупными молекулами и имеют тенденцию не обладать нужными для лекарств свойствами, такими, как удобная фармакокинетика (приемлемая биодоступность, удобство клинического применения, приемлемый период полувыведения и т. д.). Низкая аллергенность и приемлемая токсичность и уровень побочных эффектов делает их, как правило, непригодными или малопригодными для использования в клинической практике, за пределами исследовательских лабораторий.[5][6]
Привилегированная структура[править]
Привилегированная структура[7] — структурная часть молекулы, радикал или химический элемент, который или которая статистически часто повторяется среди уже известных лекарств данного фармакологического класса, среди уже известных лигандов данного типа или подтипа рецепторов или известных ингибиторов данного фермента, или среди некоего другого выделенного по неким общим признакам специфического подмножества уже известных биологически активных соединений. Эти статистически выделенные привилегированные элементы химической структуры[8] могут в дальнейшем быть использованы в качестве основы для разработки новых биологически активных соединений или новых лекарств со сходными или, возможно, даже улучшенными по сравнению с исходными соединениями свойствами, и даже для разработки целых библиотек таких соединений.
Характерными примерами являются, например, трициклические структуры разного химического строения в составе молекул трициклических антидепрессантов, или существование химически сходных целых подклассов антипсихотиков, таких, как производные бутирофенона (галоперидол, спиперон, дроперидол и др.), производные индола (резерпин, карбидин и др.), производные фенотиазина (хлорпромазин, перфеназин и др.).
См. также[править]
Источники[править]
- ↑ Teif V.B. (2005). «Ligand-induced DNA condensation: choosing the model». Biophysical Journal 89 (4): 2574–2587. DOI:10.1529/biophysj.105.063909. PMID 16085765.
- ↑ Teif VB, Rippe K. (2010). «Statistical-mechanical lattice models for protein-DNA binding in chromatin.». Journal of Physics: Condensed Matter 22 (41): 414105. DOI:10.1088/0953-8984/22/41/414105. PMID 21386588.
- ↑ (2010) «Water in Cavity-Ligand Recognition». Journal of the American Chemical Society 132 (34): 12091–12097. DOI:10.1021/ja1050082. PMID 20695475.
- ↑ Kenakin Terrance P. A pharmacology primer: theory, applications, and methods. — Academic Press. — ISBN 978-0-12-370599-0.
- ↑ (June 2011) «Design strategies for bivalent ligands targeting GPCRs». ChemMedChem 6 (6): 963–74. DOI:10.1002/cmdc.201100101. PMID 21520422.
- ↑ (December 2008) «Bivalent ligands as specific pharmacological tools for G protein-coupled receptor dimers». Curr Drug Discov Technol 5 (4): 312–8. DOI:10.2174/157016308786733591. PMID 19075611.
- ↑ http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2908274/
- ↑ PMID 19468851 (PMID 19468851)
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя бота.
↑ [+] | |
|---|---|
| По положению | |
| По способности воспринимать разные стимулы |
Мономодальные | Полимодальные | Тельце Гербста | Тельце Грандри |
| По адекватному (Сенсорная модальность) раздражителю |
Хеморецепторы | Осморецепторы | Механорецепторы (Тактильные) | Фоторецепторы | Терморецепторы | Болевые рецепторы | Электрорецепторы | Магнитные рецепторы | Тельце Пачини | Тельце Мейснера | Тельца Меркеля | Тельце Руффини | Лиганд (биохимия) | Сенсорная рецептия | Сенсорная модальность | |