Уксусная кислота
| Уксусная кислота | |

| |

| |
| Общие | |
|---|---|
| Химическая формула | CH3COOH |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 60,05 г/моль |
| Плотность | 1,0492 г/см³ |
| Термические свойства | |
| Т. плав. | 16,75 °C |
| Т. кип. | 118,1 °C |
| Кр. точка | 321,6 °C, 5,79 МПа |
| Мол. теплоёмк. | 123,4 Дж/(моль·К) |
| Энтальпия образования | −487 кДж/моль |
| Химические свойства | |
| pKa | 4,76 (Ka=1,75*10-5) |
| Оптические свойства | |
| Показатель преломления | 1,372 |
| Структура | |
| Дипольный момент | 1,74 Д |
| Классификация | |
| Рег. номер CAS | 64-19-7 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Уксусная кислота (этановая кислота, метанкарбоновая кислота) — одноосновная органическая карбоновая кислота.
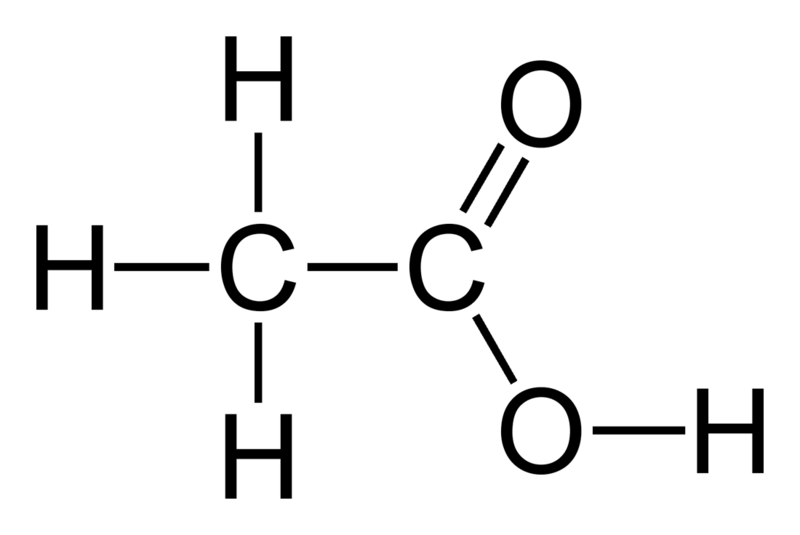
Имеет формулу CH3COOH.
Открытие уксусной кислоты приписывают Марии Гебре, Джабир ибн Хайяну, но первым её и её некоторые свойства описал Теофраст.
Физические свойства[править]
Уксусная кислота — бесцветная, растворимая в воде жидкость с острым характерным запахом. Молярная масса = 60,05 г/моль. Плотность = 1,0492 г/см³. Температура плавления = + 16,75 °C. Температура кипения = + 118,1 °C.
Химические свойства[править]
При взаимодействии с активными металлами образует соли — ацетаты.
Например, ацетат свинца(II):
PbО + 2СН3СООН → (СН3СОО)2Pb + H2O
Ацетат калия:
2CH3COOH + K2CO3 → 2CH3COOK + CO2 + H2O
Ацетат магния:
Mg + 2CH3COOH → (CH3COO)2Mg + H2
Ацетат кальция:
CaO + 2CH3COOH → (CH3COO)2Ca + H2O
Ацетат натрия:
CH3COOH + NaOH → CH3COONa + H2O
При нагревании ацетатов с этанолом в присутствии серной кислоты H2SO4 происходит реакция этерификации с образованием уксусно-этилового эфира (этилацетата):
СН3СООН + С2Н5ОН → СН3СООC2H5 + 2H2O
При взаимодействии с такими газами как хлор, водород замещается:
CH3COOH + Cl2 → CH2ClCOOH + HCl
Получилась хлоруксусная кислота. Аналогично, водород может замещаться например на фтор, с образованием фторуксусной кислоты CH2FCOOH или иод с образованием иодуксусной кислоты CH2ICOOH.
Горение этой кислоты разлагает её на углекислоту и воду:
CH3COOH + 2O2 → 2CO2 + 2H2O
Производство[править]
Уксусную кислоту получают окислением ацетальдегида кислородом в присутствии катализатора — ацетата марганца (II) Mn(CH3COO)2 при температуре 50-60 °С:
2CH3CHO + O2 → 2CH3COOH
Либо окисление н-бутана при температуре 150—200 °C и давлении 150 атм., с использованием в качестве катализатора ацетата кобальта:
2C4H10 + 5O2 → 4CH3COOH + 2H2O
Другим способом получения данной кислоты является карбонилирование метанола (метиловый спирт CH3OH) моноксидом углерода (CO):
CH3OH + CO → CH3COOH
Также можно окислить этанол (этиловый спирт С2Н5ОН):
С2Н5ОН + О2 → СН3СООН + Н2О
Аналитический анализ[править]
Для выявления присутствия уксусной кислоты при проведении анализа (см. Аналитическая химия), проводят реакцию с хлоридом железа (III) FeCl3, при этом к ацетат-ионам появляется красная окраска, обусловленная образованием основного ацетата железа:
8СН3СОО− + 3Fe3+ + Н2О → [Fe3(ОН)2(СН3СОО)6]+ + 2СН3СООН
Медицинский аспект[править]
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. При попадании концентрированной (свыше 30 %) уксусной кислоты на кожу и ткани, она способна вызывать химические ожоги, с развитием коагуляционных некрозов прилегающих тканей различной протяженности и глубины.
При попадании в желудочно-кишечный тракт концентрированной уксусной кислоты возникает тяжёлый ожог слизистой оболочки полости рта, глотки, пищевода и желудка. Возможны ацидоз, гемолиз, гемоглобинурия, нарушение свёртываемости крови, сопровождающееся тяжёлым желудочно-кишечным кровотечением. Из-за потери плазмы через обожжённую слизистую оболочку, возникает значительное сгущение крови, что может вызвать шок. Опасными осложнениями отравления уксусной эссенцией является острая почечная недостаточность и токсическая дистрофия печени.
Предельно допустимая концентрация уксусной кислоты — 5 мг/м3. При работе с этой кислотой нужно применять фильтрующие противогазы для защиты от паров.[1]