Аммиак
| Аммиак | |
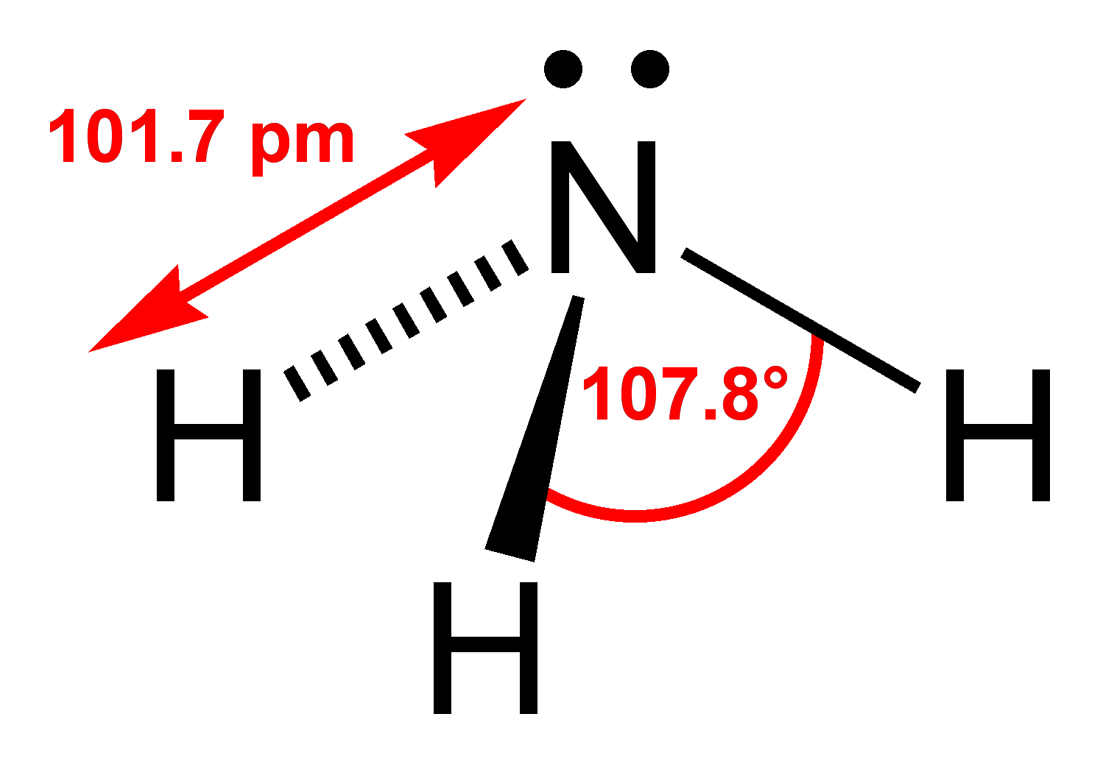
| |

| |
| Общие | |
|---|---|
| Химическая формула | NH3 |
| Физические свойства | |
| Состояние | газ |
| Молярная масса | 17.0306 г/моль |
| Плотность | 0.0007723 (н.у.) г/см³ |
| Термические свойства | |
| Т. плав. | −77.73 |
| Т. кип. | −33.34 °C |
| Кр. точка | 132.25 °C |
| Энтальпия образования | −45.94 кДж/моль |
| Химические свойства | |
| pKa | 9.21 |
| Растворимость в воде | 89.9 (при 0 °C) г/100 мл |
| Классификация | |
| Рег. номер CAS | [7664-41-7] |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Аммиак — бесцветный ядовитый газ легче воздуха с резким запахом, имеющий химическую формулу NH3.
Физические свойства[править]
Аммиак — бесцветный газ с характерным резким запахом и едким вкусом. Он почти в два раза легче воздуха. При −33,35 °С и обычном давлении аммиак сжижается в бесцветную жидкость, а при −77,75 °C замерзает, превращаясь в бесцветную кристаллическую массу. Его хранят и транспортируют в жидком состоянии в стальных баллонах под давлением 6-7 атм.
В воде аммиак растворяется очень хорошо: при 0 °С и обычном давлении в 1 объеме воды растворяется около 1200 объемов NH3, а при 20 °С — 700 объемов. Концентрированный раствор содержит 25 % NH3 и имеет плотность 0,91 г/см3. Раствор аммиака в воде называют аммиачной водой или нашатырным спиртом. Обычный медицинский нашатырный спирт содержит до 10 % NH3, аммиачная вода — от 10 % и более. При нагревании раствора аммиак легко испаряется.
Химические свойства[править]
Молекулы аммиака наделены ковалентными связями. Однако связи N — Н в молекуле аммиака полярные, так как электронная пара смещена к атому азота. Поэтому атом азота имеет отрицательный заряд, а атом водорода — положительный. В химическом отношении аммиак является восстановителем, а сам обычно окисляется до свободного азота. Так, в атмосфере кислорода аммиак горит:
- 4NH3 + 3O2 = 2N2 + 6H2O
Аммиак также легко восстанавливает монооксид меди до металлической меди при высокой температуре:
- 3CuO + 2NH3 = 3Cu + N2 + 3H2O
Гидроксид аммония[править]
При растворении аммиака в воде часть его молекул взаимодействует с водородными ионами воды с образованием сложного катиона аммония NH4+. Вместе с тем соответствующие ионы гидроксида OH− остаются в избытке. Этот процесс равновесный. Его можно изобразить следующим уравнением:
- NH3 + H2O ⇌ NH4+ + OH− ⇌ NH4OH
Отсюда следует, что в растворе аммиака в равновесии одновременно существуют молекулы аммиака, воды и гидроксида аммония.
Гидроксид аммония — очень неустойчивое вещество и может существовать только в растворе. При нагревании раствора равновесие смещается влево, и раствор разлагается на исходные вещества. Это разложение частично происходит и при обычной температуре, поэтому растворы аммиака всегда имеют специфический запах. При длительном кипячении раствора можно полностью удалить аммиак. Этим иногда пользуются в лабораториях для получения небольших количеств аммиака.
Раствор гидроксида аммония окрашивает лакмус в синий цвет. С кислотами раствор гидроксида аммония образует соли, например:
- NH4OH + HCl = NH4Cl + H2O
- NH4OH + HNO3 = NH4NO3 + H2O
- 2NH4OH + H2SO4 = (NH4)2SO4 + 2H2O
Производство[править]
В лабораторных условиях аммиак добывают обычно нагреванием смеси хлорида аммония NH4Cl с гашеной известью Ca(OH)2. Процесс образования аммиака при этом происходит в две стадии: сначала возникает гидроксид аммония,[нет источника] а затем он разлагается с выделением аммиака:
- 2NH4Cl + Ca(OH)2 = 2NH4OH + CaCl2
- NH4OH = NH3↑ + H2O
Иногда аммиак добывают нагреванием до кипения концентрированного раствора аммиака (гидроксида аммония).
В технике главным способом добывания аммиака является прямой синтез его из азота и водорода по реакции:
- N2 + 3H2 ⇌ 2NH3
Эта реакция происходит только при очень высоких давлениях (несколько сот атмосфер), высокой температуре и наличии катализатора.
На современных заводах синтез проводят в большинстве случаев при давлениях 250—350 атм, а иногда даже при 700—1000 атм. Чем больше давление, тем больше равновесие реакции смещается в сторону образования NH3, то есть в сторону увеличения выхода аммиака. Но процесс при очень высоких давлениях очень дорогой и экономически невыгоден. Температуру поддерживают около 400—450 °С. Ниже 400 °С реакция происходит очень медленно, а выше 450—500 °С аммиак заметно разлагается на азот и водород. Катализатором служит губчатое железо с примесями оксидов калия, алюминия и других веществ.
Значительные количества аммиака получают как побочный продукт при коксовании каменного угля, в котором содержится от 1 до 2,5 % азота. При коксовании угля большая часть этого азота выделяется в виде аммиака. Его удаляют из коксового газа пропусканием газа через воду.
К концу XIX века этот способ был единственным промышленным способом добывания аммиака. Лишь в 1920-х годах, когда распространился синтетический способ, он потерял свое значение.
Применение[править]
Аммиак — один из важнейших продуктов современной химической промышленности. Главной отраслью его применения является производство азотной кислоты и азотных удобрений. Кроме того, аммиак используют для производства многих других химических продуктов. Сжиженный аммиак и водный раствор аммиака применяют непосредственно как азотное удобрение.
Опасность[править]
Аммиак является токсичным газом, и поэтому надо соблюдать меры безопасности. ПДК — 20 мг/м3. При выбросе аммиака нужно эвакуироваться, двигаясь перпендикулярно ветру, а если это невозможно — спуститься вниз, так как аммиак легче воздуха и он поднимается вверх, в отличие от хлора.[1]
Источники[править]
- ↑ Памятка населению по действиям при аварии с выбросом аммиака — Администрация Балаковского муниципального района
Литература[править]
- Украинская советская энциклопедия. В 12-ти томах / Под ред. М. Бажан. — 2-е изд. — К.: Главная редакция УРЕ, 1974—1985.
- Ф. А. Деркач «Химия» — Л. 1968
Бинарные соединения водорода ↑ | |
|---|---|
| Гидриды щелочных металлов | |
| Гидриды щелочноземельных металлов | |
| Гидриды подгруппы бора | |
| Гидриды подгруппы углерода | |
| Пниктогеноводороды | |
| Халькогеноводороды | |
| Галогеноводороды | |
| Гидриды переходных металлов | |
|
см. также: | |