Синдром Тимоти
Синдром Ти́моти (СТ) — это аутосомно-доминантное генетическое заболевание, которое характеризуется множественными системными нарушениями. Основные проявления включают удлинение интервала QT на электрокардиограмме, синдактилию (сращение пальцев), врождённые пороки сердца, иммунодефицитные состояния, а также транзиторную гипогликемию. Кроме того, у пациентов наблюдаются когнитивные нарушения, расстройства аутистического спектра и поражения других органов и систем[1].
История[править]
В 1990-х годах после открытия генов, вызывающих синдром удлинённого QT, были зафиксированы случаи сочетания этой аномалии с синдактилией. Исследования в лаборатории Марка Китинга, где Кэтрин Тимоти работала координатором, позволили описать новый синдром — аутосомно-доминантное генетическое заболевание, названное в её честь[2].
Классификация[править]
СТ подразделяется на два подтипа в зависимости от локализации мутации в гене CACNA1C[3]:
- первый подтип вызывается мутацией G406R (c.1216 G>A) в экзоне 8A и характеризуется классическим тяжёлым фенотипом заболевания;
- второй подтип обусловлен той же самой мутацией G406R (c.1216 G>A), но расположенной в альтернативно сплайсированном экзоне 8, что приводит к несколько более мягкому течению заболевания.
Этиология[править]
Синдром Тимоти развивается вследствие мутаций в гене CACNA1C, расположенном на хромосоме 12p13.33. Классический вариант ТС обусловлен мутацией G406R (c.1216 G>A) в экзоне 8A, тогда как ТС 2 типа вызывается той же самой мутацией G406R (c.1216 G>A), но локализованной в альтернативно сплайсированном экзоне 8. Атипичная форма синдрома может развиваться при любых других мутациях гена CACNA1C (за исключением изменения G406R), которые приводят к характерным мультисистемным нарушениям [3].
Патогенез[править]
СТ связан с патологическими изменениями в гене CACNA1С, который отвечает за кодировку α-субъединицы кальциевых каналов L-типа. Эти каналы играют ключевую роль в транспорте ионов кальция внутрь клеток, обеспечивая важные физиологические процессы: сокращение мышечных волокон, нейрональную активность головного мозга и регуляцию сердечного ритма. При мутациях гена CACNA1С происходит структурное изменение кальциевых каналов, приводящее к их аномально длительной активности. В результате наблюдается чрезмерный входящий кальциевый ток, что повышает возбудимость клеток и создаёт предпосылки для развития опасных аритмий, потенциально угрожающих жизни пациента. Данный механизм объясняет кардиологические и неврологические проявления заболевания [1].
Эпидемиология[править]
СТ является крайне редким заболеванием: в мире по разным данным зарегистрирован от 60 до 100 случаев [3][4].
Диагностика[править]
Клиническая картина
Классическая форма СТ характеризуется множественными клиническими проявлениями. Особое диагностическое значение имеет выявление синдактилии, которая может затрагивать два-три пальца на руках или пальцы стоп, быть односторонней или двусторонней. Типичными фенотипическими особенностями являются лицевой дисморфизм (уплощённая переносица, микрогнатия верхней челюсти, микродентия, низко посаженные уши), а также гипотрихоз, отсутствие волос при рождении и их разреженность в дальнейшем [1].
Кардиологические аномалии встречаются в 70% случаев и включают: открытый артериальный проток, дефекты межжелудочковой перегородки, тетраду Фалло, признаки гипертрофической кардиомиопатии. Неврологические и психические нарушения представлены расстройствами аутистического спектра, судорожным синдромом, когнитивными нарушениями, мышечной гипотонией. Характерны задержка речевого развития и трудности формирования навыков самообслуживания. Дополнительными признаками служат повышенная подверженность инфекционным процессам (ЛОР-органы, бронхолёгочная система), связанная с врождённым иммунодефицитом [1].
Также СТ характеризуется задержкой роста, нарушением полового развития, а также расстройства сна (встречаются у 33-60% больных в зависимости от генетического варианта) [5].
При СТ могут наблюдаться тяжёлые нарушения дыхательной функции: спонтанная остановка дыхания, которые встречаются с одинаковой частотой во всех группах пациентов. Зафиксирован случай смерти младенца на фоне первичной лёгочной гипертензии без документированных аритмий. У детей раннего возраста, особенно у мальчиков с ТС, отмечаются рецидивирующие пневмонии, а в последующем развитие астмы.. Причины дыхательной дисфункции остаются неясными, но могут быть связаны с нарушением развития лёгких вследствие преждевременных родов или аномальной лёгочной функции после кесарева сечения [5].
Инструментальная диагностика
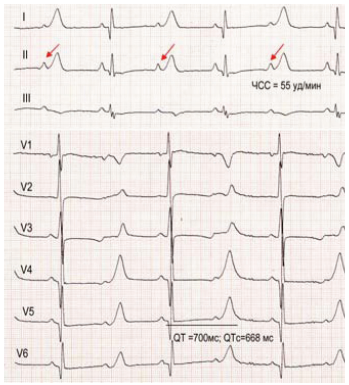
Для СТ характерны следующие патогномоничные изменения при электрокардиографии [1]:
- выраженное удлинение QT-интервала до 480-700 м/с;
- функциональная атриовентрикулярная блокада второй степени;
- выраженная синусовая брадикардия;
- макроальтернация Т-зубцов.
При эхокардиографии: при СТ наиболее часто выявляются открытый артериальный проток, открытое овальное окно, дефект межжелудочковой перегородки, тетрада Фалло и признаки гипертрофической кардиомиопатии [1].
Лабораторная диагностика
Биохимический анализ крови: возможна транзиторная гипогликемия [1]
Молекулярно-генетический анализ: выявляется мутация в гене CACNA1C методом секвенирования [3].
Пренатальная диагностика
СТ может быть заподозрен ещё во внутриутробном периоде на основании выявления аномальной частоты сердечных сокращений у плода (фетальной брадикардии) [4].
Дифференциальная диагностика[править]
Дифференциальная диагностика СТ проводится со следующими состояниями [4]:
- синдром Андерсена — Тавила;
- синдром Джервелла — Ланге — Нильсена;
- синдром Барде — Бидля;
- синдром Смита — Лемли — Опица;
- приобретённое удлинение QT интервала;
- гипокалиемия;
- приём препаратов, блокирующих калиевые каналы.
Осложнения[править]
К возможным осложнениями СТ относятся [1]:
- желудочковая тахикардия с трансформацией в фибрилляцию желудочков;
- тяжёлые инфекционные осложнения;
- декомпенсированная гипогликемия с жизнеугрожающими последствиями;
- внезапная сердечная смерть;
- прогрессирующая сердечная недостаточность;
- судорожный синдром;
- остановка дыхания.
Лечение[править]
Основу лекарственной терапии составляют бета-блокаторы, которые блокируют действие адреналина и предотвращают резкое увеличение частоты сердечных сокращений. Хотя эти препараты успешно применяются при других формах наследственного синдрома удлинённого QT, данные международных регистров свидетельствуют о низкой эффективности данной терапии [4].
Наиболее эффективным методом лечения является имплантация кардиовертера-дефибриллятора, который распознаёт жизнеугрожающие аритмии и восстанавливает нормальный сердечный ритм. Для коррекции выраженной брадикардии, связанной с атриовентрикулярными блокадами, у младенцев нередко применяют кардиостимуляторы [4].
Наряду с кардиологическим лечением, важное значение имеет терапия внесердечных проявлений болезни:
- частые респираторные инфекции требуют назначения антибиотиков, не вызывающих удлинение QT-интервала.
- хирургическая коррекция синдактилии возможна, но должна проводиться под кардиологическим мониторингом, поскольку анестезия может провоцировать опасные аритмии у этих пациентов [4].
Левосторонняя симпатическая денервация сердца остаётся малоизученным методом лечения при СТ из-за ограниченного числа проведённых операций. Имеющиеся данные не позволяют сделать однозначных выводов об эффективности этой процедуры [5].
Имеются данные о необходимости досрочного родоразрешения из-за потенциальных рисков, связанных с брадикардией. Однако соотношение пользы и рисков преждевременного родоразрешения остаётся невыясненным [5].
Прогноз[править]
Без своевременного и адекватного лечения сердечных нарушений СТ в большинстве случаев приводит к летальному исходу в младенческом или раннем детском возрасте. Основными причинами смерти становятся жизнеугрожающие аритмии, которые могут развиться на фоне инфекционных заболеваний, тяжёлых системных нарушений, эпизодов гипогликемии или как осложнение анестезии при медицинских вмешательствах [3].
Диспансерное наблюдение[править]
Динамическое наблюдение за больными включает регулярный контроль концентрации глюкозы крови и оценку сердечной деятельности. Следует избегать любых лекарственных средств, способных удлинять QT-интервал или снижать концентрацию сахара крови. Для улучшения качества жизни пациентов часто требуется мультидисциплинарный подход с участием различных специалистов, поскольку кишечные осложнения, эпизоды гипогликемии и задержка развития требуют особого внимания и индивидуальных программ реабилитации [4].
Профилактика[править]
Не разработана.
Источники[править]
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 Беляева М. М., Ильдарова Р. А., Школьникова М. А. Синдромы Андерсена-Тавила, Тимоти, Джервелла-Ланге-Нильсена: полиорганная патология с высоким риском внезапной сердечной смерти // Педиатрия. Журнал им. Г. Н. Сперанского. — 2016. — № 3.
- ↑ Timothy, K.W.; Bauer, R.; Larkin, K.A. et al. A Natural History Study of Timothy Syndrome англ. // Orphanet Journal of Rare Diseases : статья. — 2024. — том 19. — С. 433. — DOI:10.1186/s13023-024-03445-x
- ↑ 3,0 3,1 3,2 3,3 3,4 Peter Schwartz Timothy syndrome англ.. Orphanet (2020-11).
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 Timothy Syndrome (английский). National Organization for Rare Disorders (2005).
- ↑ 5,0 5,1 5,2 5,3 Timothy K.W., Bauer R., Larkin K.A. et al. A Natural History Study of Timothy Syndrome. — 2024. — том 19. — С. 433. — DOI:10.1186/s13023-024-03445-x
Литература[править]
- Школьникова М.А., Романцова З.О., Термосесов С.А., Кравцова Л.А., Миклашевич И.М., Воинова В.Ю., Ильич И.Л., Калинин Л.А. Сочетание удлинённого интервала QT, атриовентрикулярной блокады и синдактилии как проявление редкого наследственного заболевания с высоким риском внезапной сердечной смерти. — 2008. — № 51. — С. 52-57.
- Бокерия Ольга Леонидовна, Санакоев Мераб Константинович Синдром удлинённого Q-T-интервала // Анналы аритмологии. — 2015. — № 2.
Синдромы врожденных аномалий ↑ | |
|---|---|
| Краниофациальная аномалия | |
| Маленький рост | |
| Конечности | |
| Синдром избыточного роста | |
| Лоренс-Мун-Барде-Бидль | |
| Другие |
|
Одним из источников, использованных при создании данной статьи, является статья из википроекта «Рувики» («ruwiki.ru») под названием «Синдром Тимоти», расположенная по адресу:
Материал указанной статьи полностью или частично использован в Циклопедии по лицензии CC-BY-SA 4.0 и более поздних версий. Всем участникам Рувики предлагается прочитать материал «Почему Циклопедия?». |